癌症是一种基因组疾病,由体细胞突变驱动。癌症基因组受中心法则的细胞机制调控,导致转录组和蛋白质组的失调,并最终表现为临床症状。然而,癌症的蛋白质组和临床特征无法完全通过基因组和转录组解释,这表明存在广泛的转录后和翻译调控。
RNA的化学修饰被认为是解释这些差异的重要因素之一。m6A是人类RNA中最丰富的内部化学修饰。这种表观转录组标记调控RNA生命周期的几乎所有方面,包括二级结构形成、剪接、核输出、翻译和降解。至少有28种酶能够识别、添加或去除m6A,从而实现动态的转录本调控。
三方面证据表明m6A在肿瘤的发生和进展中发挥作用:
A)首先,相较于正常组织,不同类型的癌症中m6A的整体水平发生特异性改变。
B)其次,m6A相关酶的突变在多种癌症类型中常见,并且这些酶的功能紊乱会影响肿瘤表型。
C)第三,癌基因和抑癌基因中的特定m6A修饰位点会通过影响转录本稳定性和翻译速率来调控蛋白质丰度。

文章索引
【发表期刊】Nature Genetics
【发表日期】2025年3月24日
【IF】31.7
研究结果
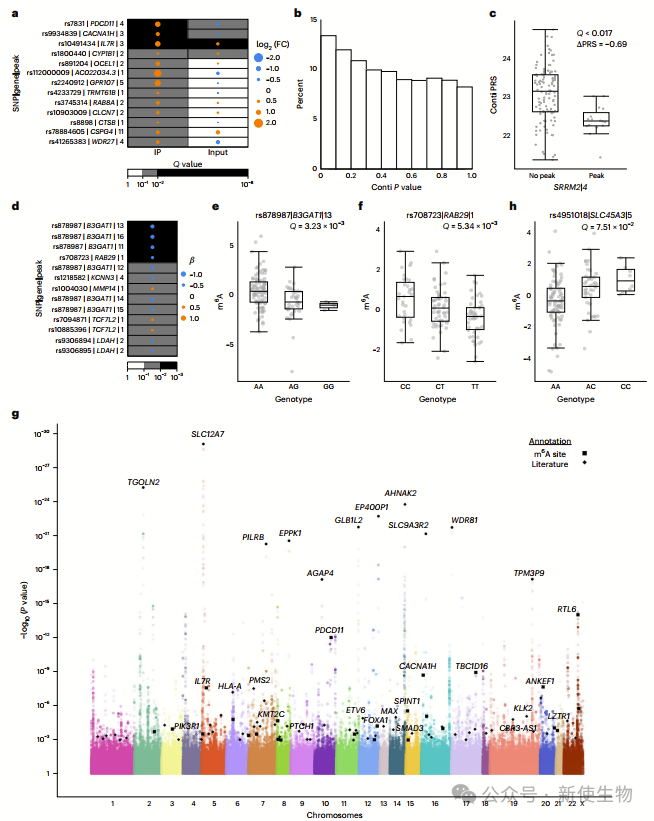
作者对148例前列腺癌样本进行m6A测序,鉴定出32051个m6A峰,富集于终止密码子附近。
癌基因MYC、AR等高频甲基化,抑癌基因TP53、PTEN较少修饰。m6A修饰与RNA丰度负相关,对蛋白翻译调控作用较弱。
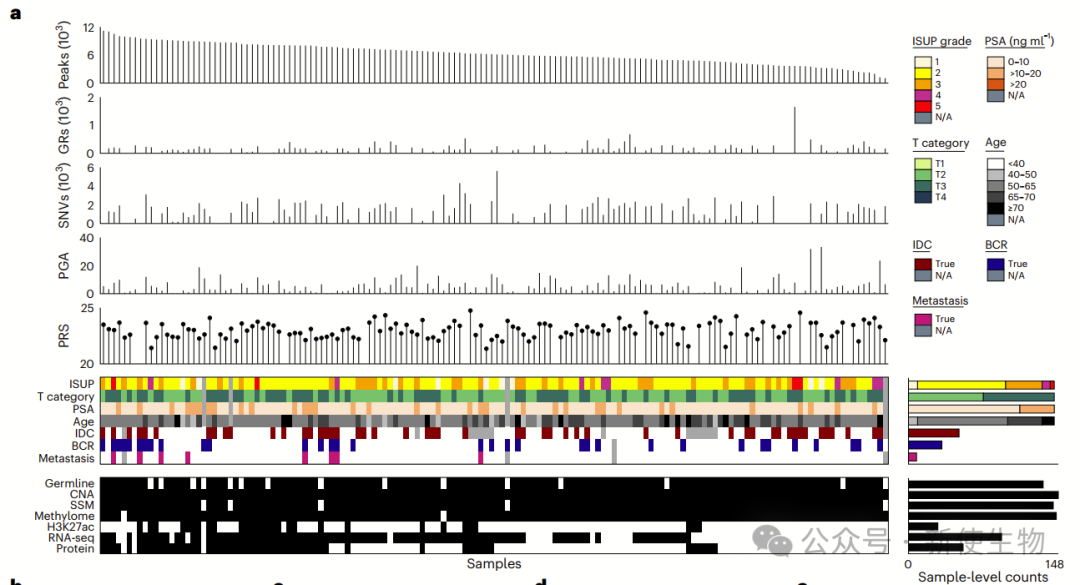
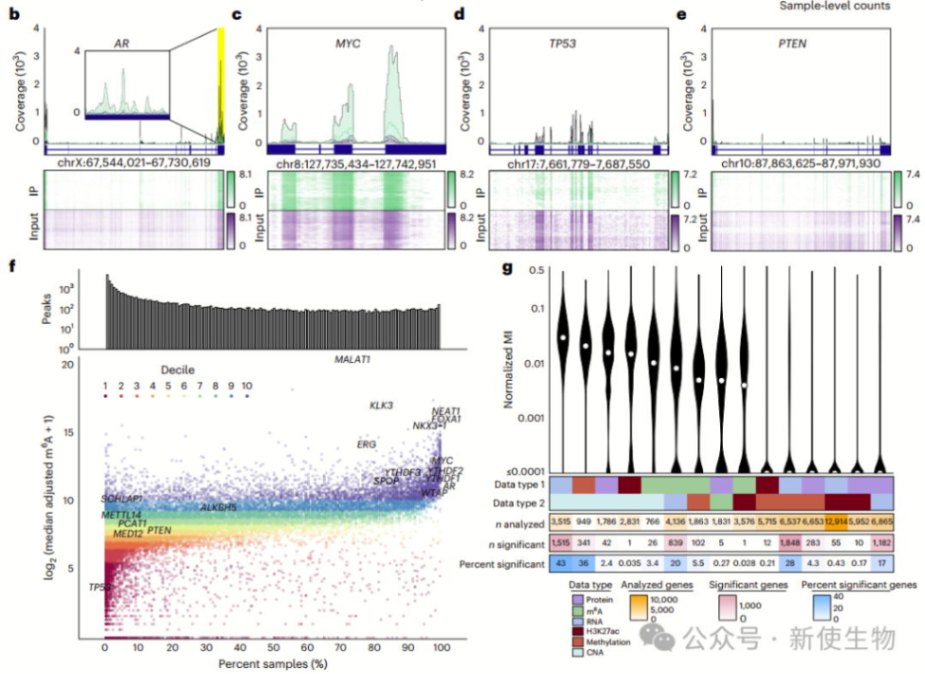
m6A聚类分析揭示前列腺癌五种m6A亚型(M1–M5),与肿瘤分期、侵袭性亚型、基因组不稳定性及复发率相关,并与mRNA和CNA亚型部分重叠,表现出特定的基因组改变(如YTHDF1扩增、FANCA缺失)。

作者发现特定位点的m6A修饰与前列腺癌的诊断年龄、分期、PSA水平、病理分级及IDC/CA亚型相关。
IDC/CA阳性患者m6A峰增多,FANCA、TP53缺失更常见,反映其临床特征。
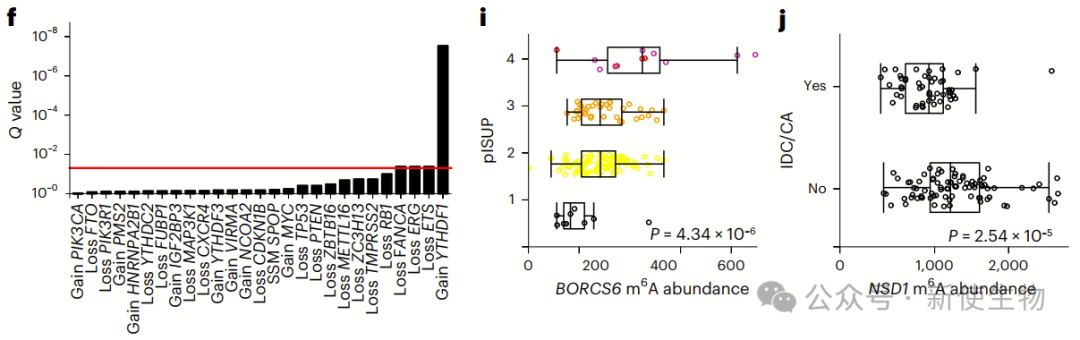
前列腺癌m6A修饰受生殖系遗传调控,鉴定出多个与m6A水平和临床特征相关的SNPs。
m6A-QTL分析揭示广泛遗传影响,涉及关键癌症基因,提示m6A在肿瘤发生中的潜在作用。
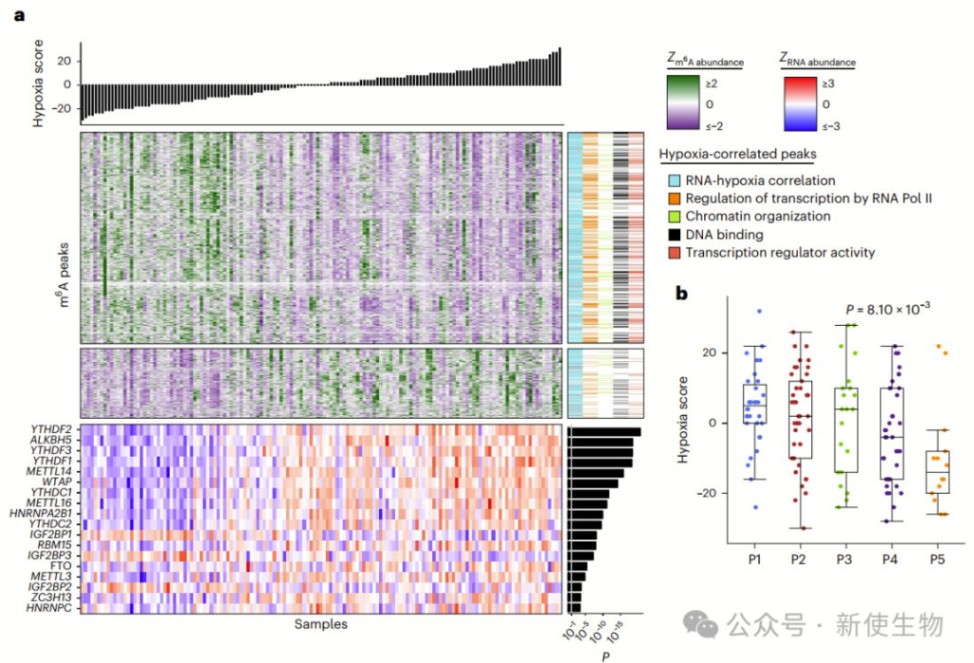
缺氧导致广泛的m6A异常,与肿瘤等级、IDC/CA和复发相关。研究团队共鉴定出2280个缺氧相关的m6A峰,主要富集于基因表达调控基因,并在缺氧肿瘤中减少。
m6A亚型与缺氧水平相关,其中P5群最为缺氧。细胞实验验证了这些缺氧相关m6A变化,包括HNRNPLL在内的9个峰在患者和细胞模型中均表现出一致的缺氧相关性。

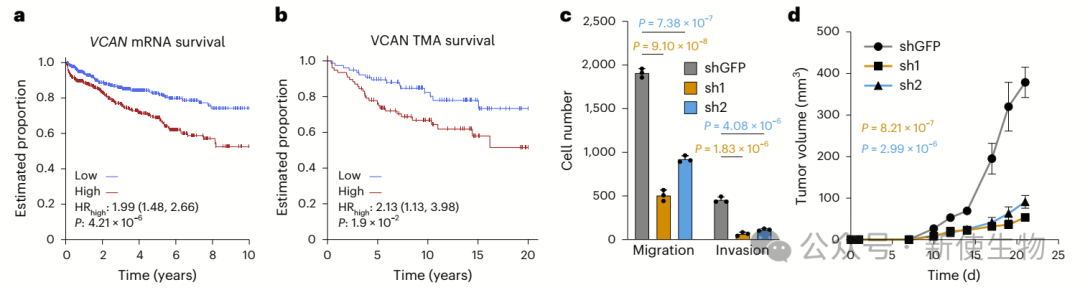
m6A相关酶常发生体细胞突变,并与前列腺癌分级及复发相关。六个独立队列分析显示,m6A调控基因的CNA可预测疾病复发,其中VIRMA和YTHDF3增加影响最大。
3432个m6A峰与驱动基因突变相关,形成特定功能簇。TP53缺失伴随高m6水平显著增加复发风险,INHBA、VCAN和ZFHX4 m6A修饰也与不良预后相关。这些结果说明m6A具有重要的前列腺癌预后价值。


研究发现,VCAN的m6A修饰与前列腺癌的进展密切相关。
VCAN在肿瘤中的表达水平较高,且与较差的预后相关。敲低VCAN能显著抑制癌细胞的增殖、迁移和侵袭,且减缓肿瘤生长。这表明VCAN通过m6A修饰促进前列腺癌恶性发展。
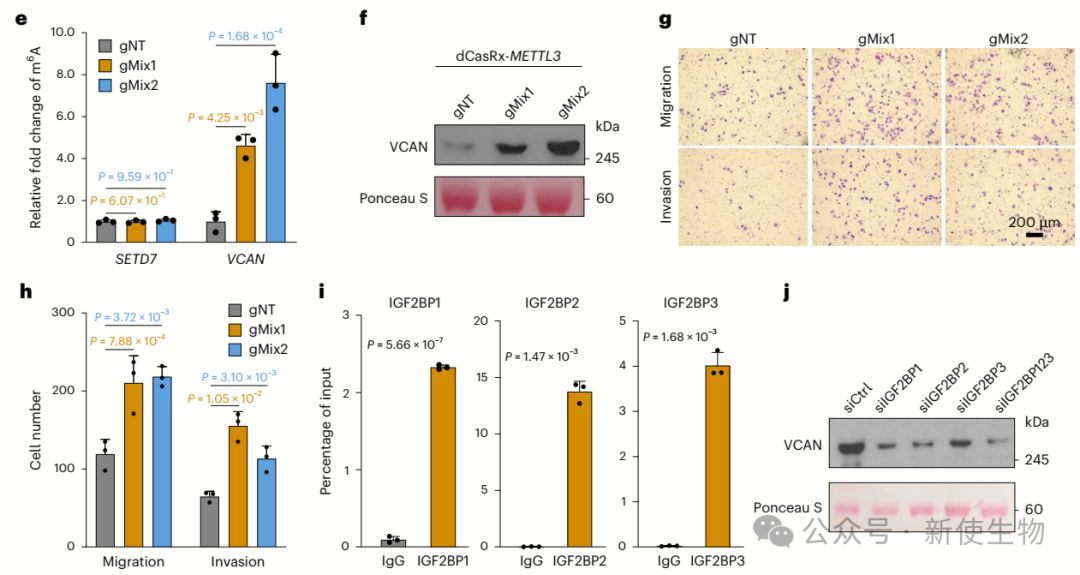
作者发现,m6A修饰通过稳定VCAN mRNA并促进其翻译,从而增强前列腺癌细胞的侵袭性。
敲低METTL3导致VCAN mRNA丰度下降,而敲低ALKBH5和FTO则增加VCAN mRNA丰度。通过使用CasRx/METTL3系统进行VCAN转录本的编辑,m6A修饰显著提高VCAN的mRNA和蛋白水平。
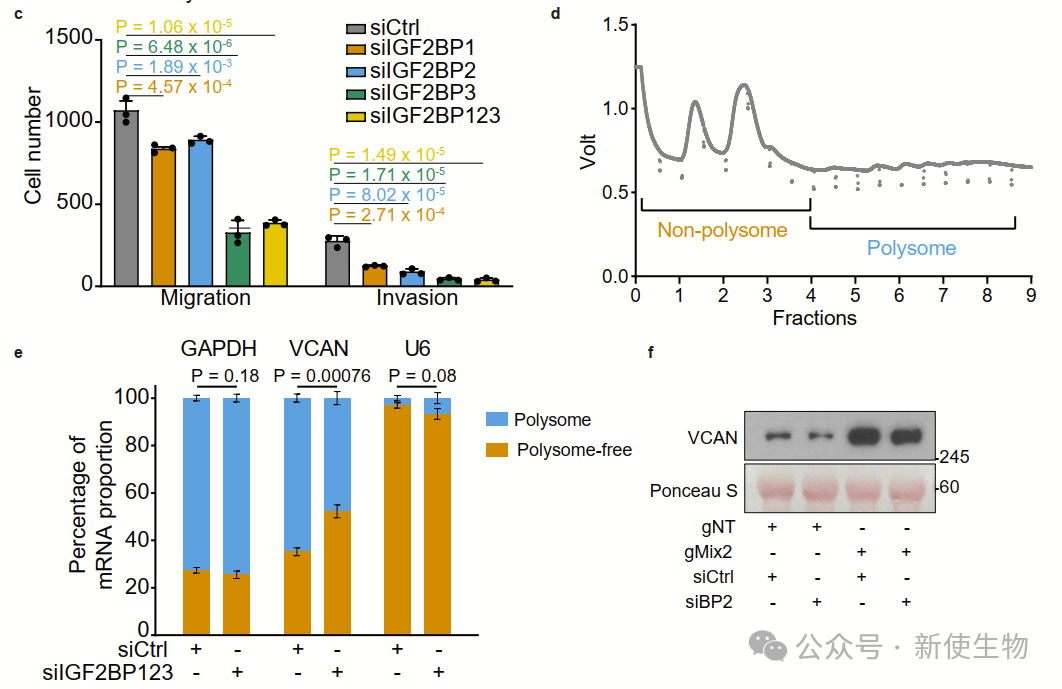
此外,Polysome profiling多聚核糖体分析和Ribo-seq核糖体印迹分析显示IGF2BP1–IGF2BP3作为m6A阅读因子,能够结合VCAN mRNA,促进其稳定和翻译,增强细胞的增殖和迁移。这表明m6A修饰通过IGF2BP蛋白调控VCAN,推动前列腺癌的进展。
总结
本研究发现前列腺癌中的m6A丰度差异与种系多态性、体细胞突变共同作用,影响预后并具有生物标志物潜力。肿瘤缺氧可导致m6A失调,特定m6A位点与疾病进展、肿瘤生长和转移相关。因此,m6A失调与前列腺癌的种系风险、微环境变化、体细胞突变和转移密切相关。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们