2025年4月24日,美国纽约洛克菲勒大学Sohail F. Tavazoie和QiushuangWu在Cancer Cell上发表了一篇题为“Ribosomal rebellion: When protein factories drive cancer progression”的评论文章。阐述Kuzuoglu-Ozturk等人发现eIF4A介导的促癌转录本翻译起始增强驱动了癌症进展。而Weller等人则揭示了异常的tRNA修饰如何破坏翻译准确性,从而产生新抗原。

综述整理
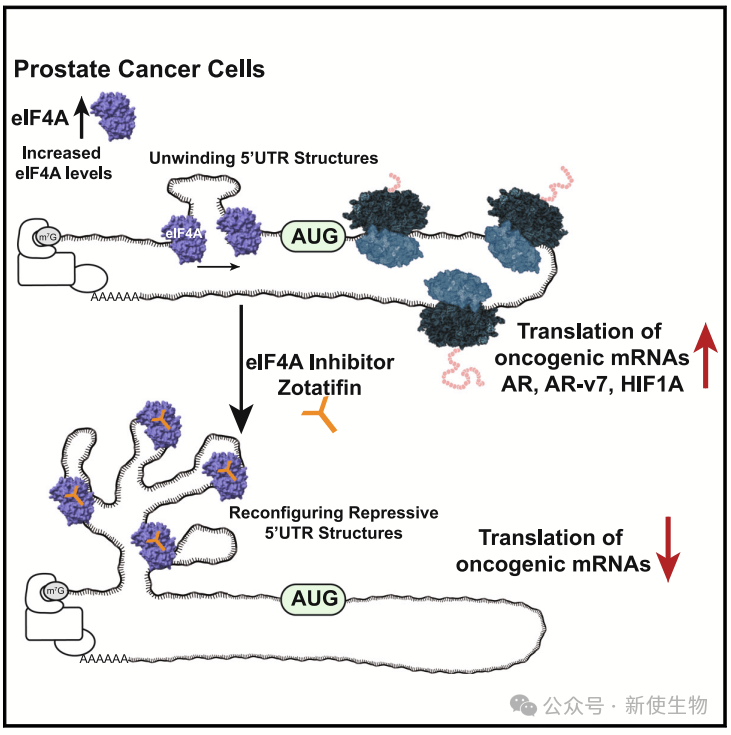
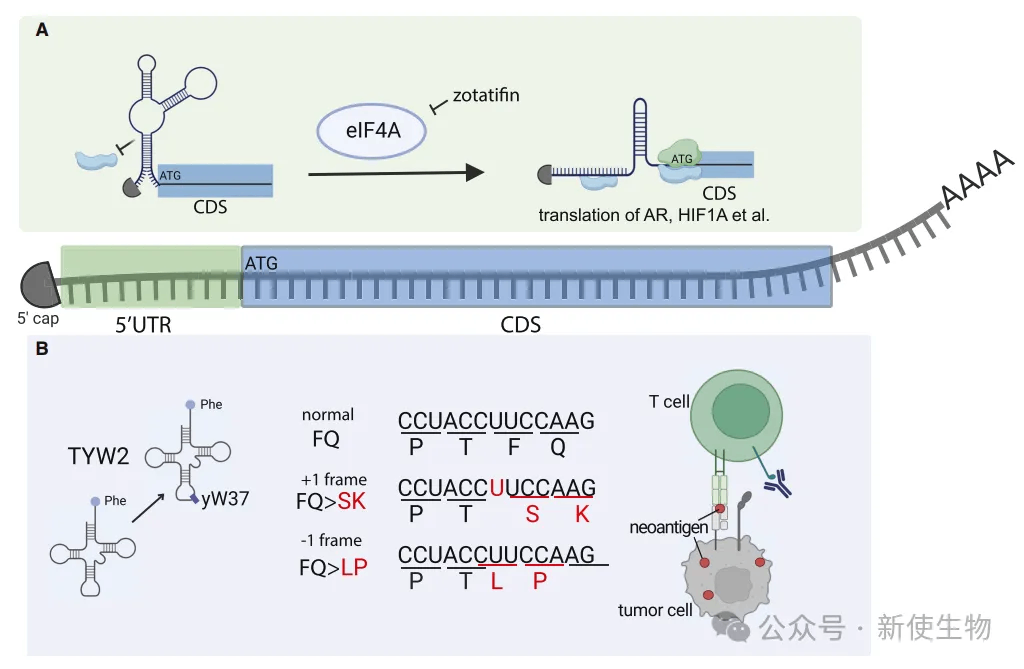
Ruggero课题组的Kuzuoglu-Ozturk等人发现,特定转录本5' UTR的RNA结构通过影响翻译起始,参与了去势抵抗性前列腺癌(CRPC)进展。5' UTR中的结构元素阻碍核糖体扫描,需要eIF4A解旋酶介入。
研究表明,eIF4A在前列腺癌中过度表达,与预后不良相关。其抑制剂zotatifin可体内抑制肿瘤生长和转移。Ribo-seq核糖体印迹分析和蛋白质组分析鉴定出zotatifin下调的108种与肿瘤发生、激素信号及碳代谢相关的蛋白,重点包括雄激素受体(AR)和HIF1α。
机制上,zotatifin通过改变AR和HIF1α的5' UTR结构,阻碍核糖体扫描,抑制其翻译。联合AR抑制剂可进一步增强抗肿瘤效果。
研究强调了eIF4A及其抑制剂在癌症治疗中的潜力,提示zotatifin有望作为广谱抗癌药物应用。
点击图片查看详细文章解读
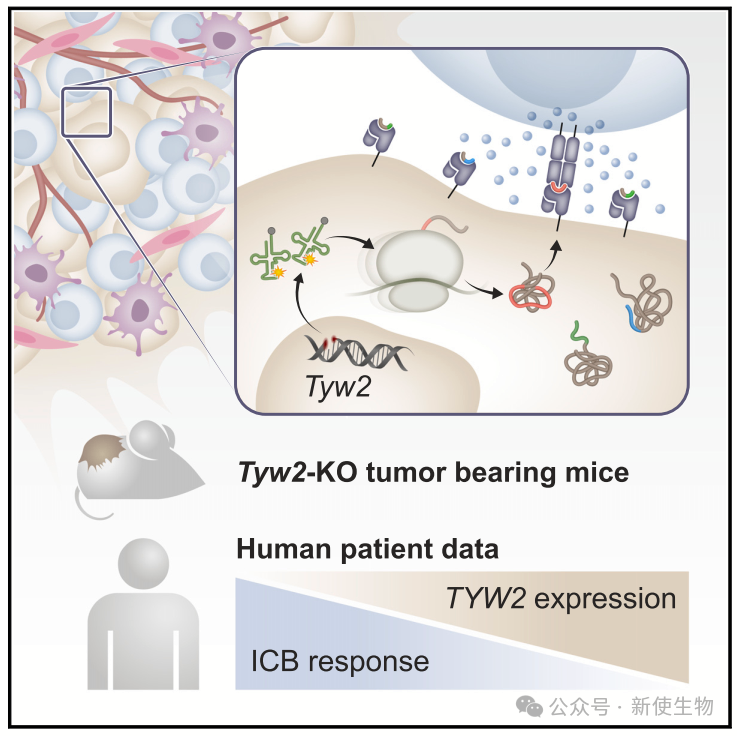
Samuels课题组的Weller等人利用Ribo-seq核糖体印迹分析,发现tRNA修饰酶TYW2缺失导致翻译延伸期间在苯丙氨酸(Phe)位点出现核糖体移码,生成新的抗原肽。
免疫肽组分析表明,缺失TYW2的黑色素瘤细胞系能产生被免疫系统识别的新抗原,并激活CD8+ T细胞。
敲除TYW2可在免疫正常小鼠中抑制肿瘤生长,且增强对PD-1免疫检查点抑制治疗的敏感性。人类原发性黑色素瘤中,低TYW2表达也与更佳预后和免疫治疗反应相关。
研究揭示了翻译调控中的关键脆弱点,为提升免疫治疗效果提供了新策略。
点击图片查看详细文章解读
总结来说,这两项引人注目的研究强调了靶向翻译调控作为癌症治疗新策略的重要性,并突出了持续深入研究翻译机制在理解人类疾病中的关键价值。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们