导读
蛋白质翻译调控是一种至关重要且严格控制的调控过程,有助于细胞间表型多样性的产生,即使是具有相同或相似基因型的细胞也是如此。
在翻译的所有步骤中,起始是最耗能和时间的阶段。在真核生物中,这一过程始于形成43S前起始复合物(PIC),包括40S核糖体、eIF1、eIF1A、eIF3复合物(eIF3A-M)、eIF5和三联复合物(TC,由eIF2α/β/γ、tRNAiMet和GTP组成)。在43S PIC形成后,eIF4F复合物被招募,连同mRNA一起形成48S起始复合物(IC)。在48S IC识别到第一个配对的AUG起始密码子后,60S核糖体加入以启动翻译延伸。
这一过程需要多个复合物和因子的协调以严格调控蛋白质翻译。重要的是,细胞在环境应激条件下采用各种机制抑制翻译起始,然而详细的分子机制尚未完全阐明。
2024年4月19日,复旦大学医学表观遗传学与代谢国际合作实验室程净东团队在Cell Research上发表了题为“Human tumor suppressor PDCD4 directly interacts with ribosomes to repress translation”的论文。本文重点研究了一类重要的肿瘤抑制因子PDCD4,并探索了PDCD4作为翻译抑制因子在翻译调控过程中的新机制。

文章索引
【标题】Human tumor suppressor PDCD4 directly interacts with ribosomes to repress translation
【发表期刊】Cell Research
【发表日期】2024年4月19日
【作者及团队】复旦大学医学表观遗传学与代谢国际合作实验室程净东团队
【IF】44.1
研究结果
PDCD4与起始因子eIF4A相互作用,阻止其进入eIF4F复合物,起到翻译抑制作用。
在压力下,如DNA损伤或营养匮乏,PDCD4从核移动到细胞质。在葡萄糖饥饿条件下,PDCD4主要与细胞质中的40S核糖体相关,与正常生长细胞核中的PDCD4相比富集约10倍。
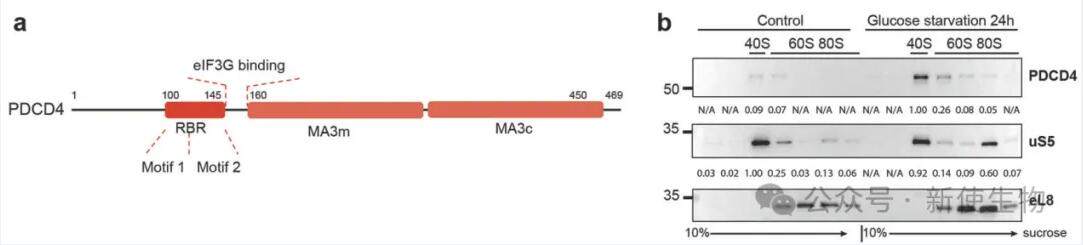
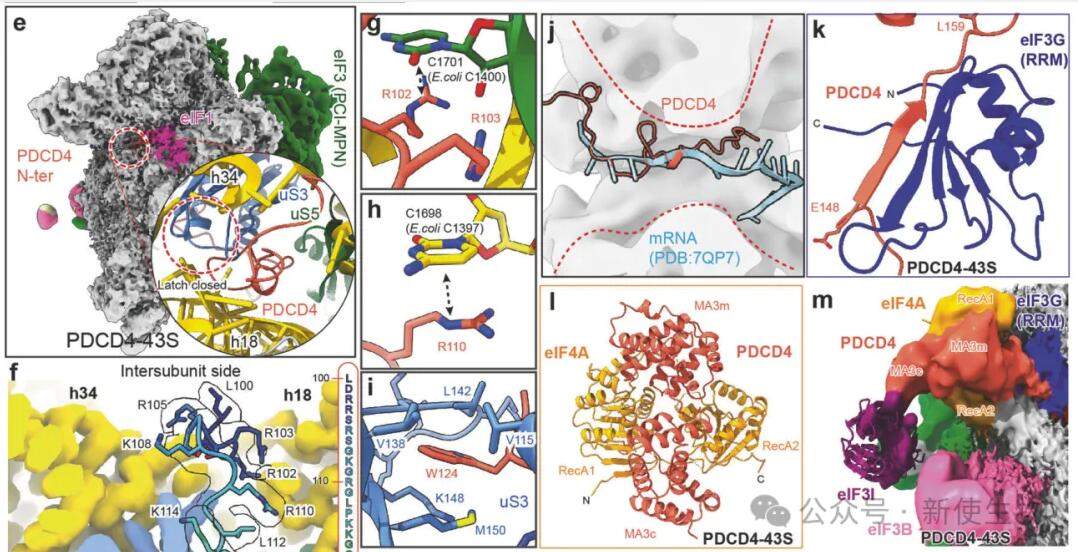
研究团队从细胞中提取PDCD4蛋白及其关联的复合物进行结构研究,他们发现了三种结构:PDCD4–40S、PDCD4–eIF3G–40S和PDCD4–43S。
在这些结构中,PDCD4的一部分位于核糖体入口通道,被称之为核糖体结合区域(RBR)。PDCD4–40S状态显示了空闲的40S核糖体亚单位与PDCD4结合,而其余部分则不可见。在PDCD4–eIF3G–40S状态中,除了PDCD4–40S的结构外,还有额外的密度,表示存在eIF3G。在PDCD4–43S状态中,作者观察到了额外的结构,允许对PDCD4的一部分和一个eIF4A进行分析。

在PDCD4–43S状态下,43S PIC的组装受到抑制,因为PDCD4的核糖体结合区域(RBR)阻止了eIF1A和TC的结合,具体而言PDCD4的RBR位于40S核糖体的mRNA通道内,阻碍了48S IC的形成,并阻止了eIF1A的结合。
此外,PDCD4的RBR与其他核糖体休眠因子相似,也与SARS-CoV-2的一般翻译抑制物NSP1具有相似的结合位点。
在PDCD4–43S中,PDCD4的C端MA3结构域通过与eIF3G的相互作用稳定,与eIF4A位于mRNA进入位点上。因此,这个位点既是eIF4A的招募枢纽,也是其抑制平台。
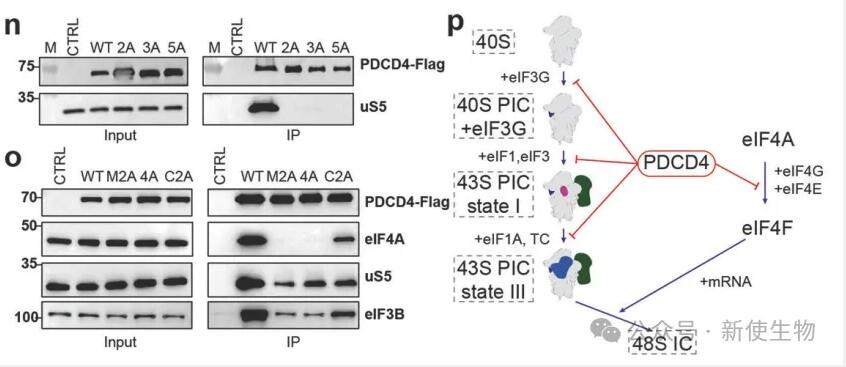
研究团队进行了结构分析后进行了突变研究,发现PDCD4的Motif 1和Motif 2对核糖体结合至关重要,他们还通过Co-IP实验和多聚核糖体蔗糖梯度分析验证了这一关键结合区域和作用机制。这一研究揭示了肿瘤发生与翻译起始抑制之间的联系。
总结
本文提出了PDCD4在抑制翻译起始中的作用模型:在压力下,PDCD4占据mRNA通道和抑制eIF4A,阻碍了翻译的启动。这一研究揭示了肿瘤发生与翻译起始抑制之间的联系。
新使生物(neoribo)推出国内首款超高分辨率翻译组建库试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时!
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。

感谢关注新使生物,核糖体分析可以联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们