导读
乳酸是有氧糖酵解的副产物,但也参与表观遗传修饰,如赖氨酸乳酰化(Kla),Kla直接影响基因转录和免疫细胞稳态。在病理情况下,高水平的Kla与多种疾病相关。在肿瘤中,乳酸释放增加,形成酸性肿瘤微环境,促进肿瘤生长并影响免疫。
翻译延伸因子1A(eEF1A)是真核蛋白组中最丰富和保守的蛋白之一。作为翻译延伸的调节因子,eEF1A在蛋白质合成过程中促进核糖体与氨酰tRNA的结合。
目前已知eEF1A2参与肿瘤发生和癌症发展:
A)eEF1A2的重新激活刺激磷脂信号传导,并促进依赖Akt的细胞迁移和肌动蛋白重塑,最终有利于肿瘤发生。
B)eEF1A2通过后转录修饰促进肿瘤进展。eEF1A2甲基化作为肿瘤适应其增强的翻译需求的机制。由于转录后修饰是简单高效的调节蛋白质功能的方法,是否存在其他参与eEF1A2介导的肿瘤调节的转录后修饰还有待研究。
2024年2月15日,北京协和医学院浦洋团队在PNAS上发表了一篇题为“KAT8-catalyzed lactylation promotes eEF1A2-mediated protein synthesis and colorectal carcinogenesis”的论文,文章发现eEF1A2乳酰化有助于提高蛋白质合成,从而促进肿瘤生长,揭示了一种Kla介导的肿瘤适应异常翻译需求的机制,并确定了KAT8作为一个可在癌症治疗中靶向的Kla写入体,为癌症治疗提供了潜在靶点。

文章索引
【标题】KAT8-catalyzed lactylation promotes eEF1A2-mediated protein synthesis and colorectal carcinogenesis
【发表期刊】PNAS
【发表日期】2024年2月15日
【作者及团队】北京协和医学院浦洋团队
【IF】9.66
研究结果
一. 全局乳酰化水平升高与肿瘤进展及结直肠癌患者的不良预后相关
Warburg效应是癌症的标志之一,其副产物乳酸被视为结直肠癌(CRC)患者预后的指标。
作者发现在结直肠癌组织中,全局乳酰化水平与癌症侵袭性和患者预后相关。结直肠癌细胞和肿瘤样本中的乳酸水平与乳酰化程度密切相关,说明乳酸是调节乳酰化的关键因素。
糖酵解抑制剂降低了乳酸水平和乳酰化水平,并抑制了癌细胞增殖。这些发现揭示了乳酸调节细胞增殖的机制,并为结直肠癌的发生和进展提供了新视角。

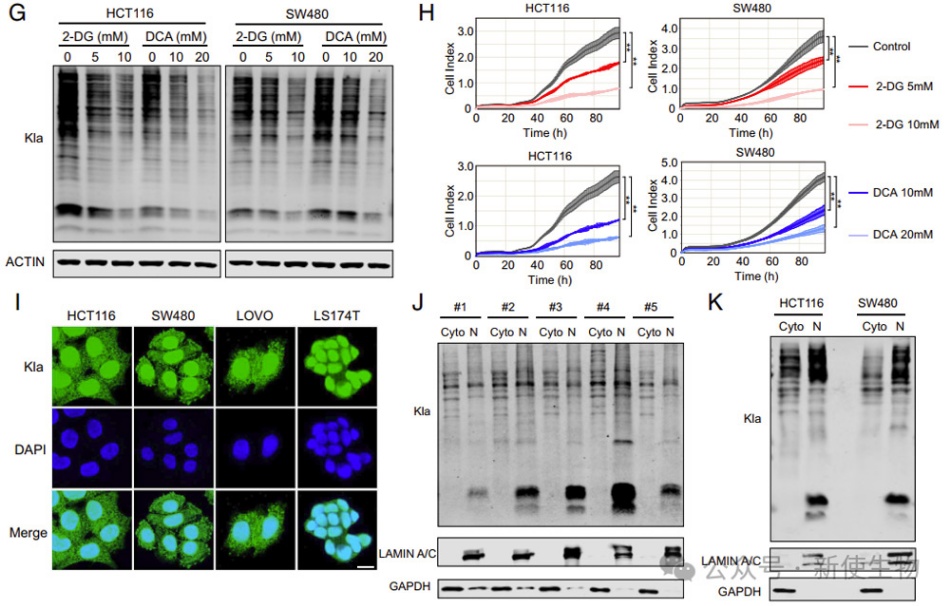
二. 结直肠癌中eEF1A2发生高乳酰化
作者在结直肠癌组织中发现了超过1200个蛋白质乳酰化位点,涉及约850个蛋白质,不仅局限于细胞核,还分布在细胞质等位置,显示乳酰化作用广泛。
结直肠癌组织中的乳酰化水平存在变化,与翻译过程相关。他们特别关注了eEF1A2的乳酰化,该蛋白是经典的mRNA翻译因子。体外验证显示了结直肠癌细胞中eEF1A2的乳酰化,进一步证实了这一结果。
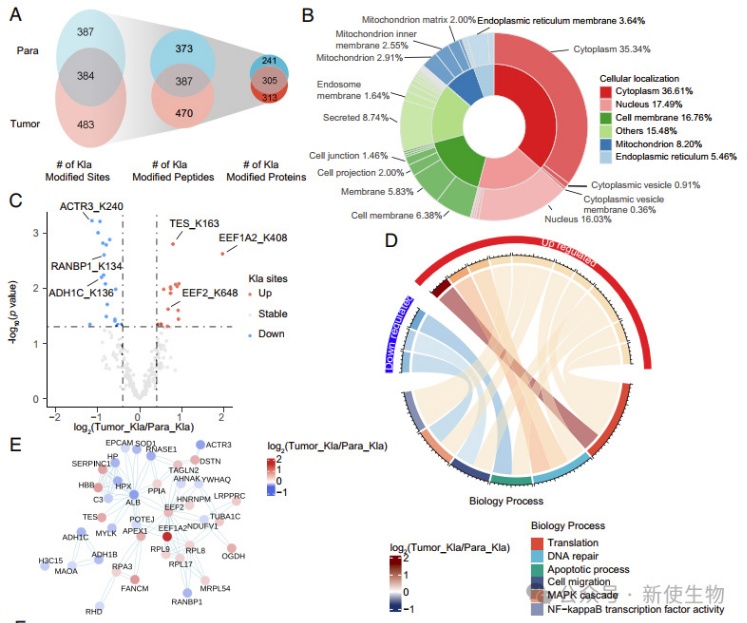
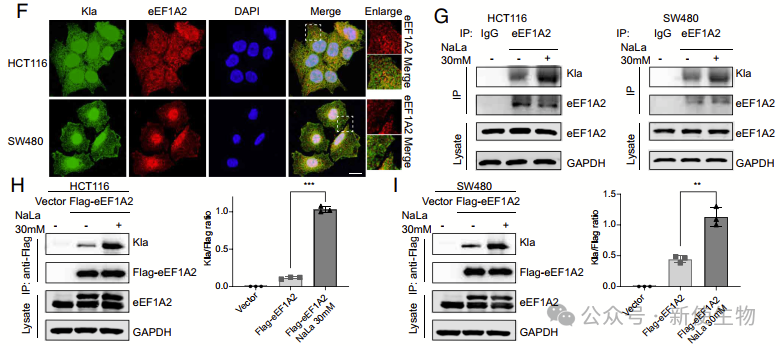
三. eEF1A2的乳酰化促进了肿瘤细胞的增殖
通过结直肠癌(CRC)活检、质谱分析显示,eEF1A2的主要乳酰化位点是赖氨酸残基408。作者通过将K408突变为R来模拟eEF1A2的乳酰化,发现K408R突变导致Kla显著减少。
研究团队进一步预测了eEF1A2K408R突变的结构,发现与原始结构相比没有明显的构象变化。体内外实验都证实,eEF1A2K408la促进了CRC细胞的增殖。
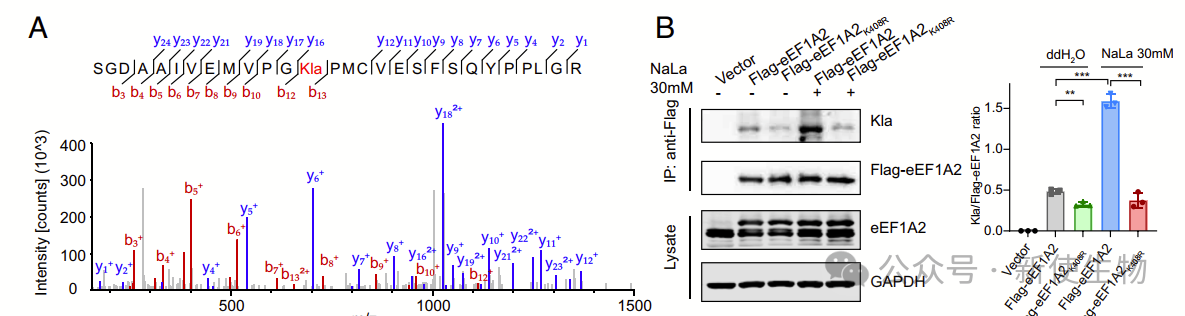
四. eEF1A2的乳酰化介导了细胞中增强的蛋白质合成
eEF1A2是一个重要的GTP酶,在蛋白质合成过程中招募氨基酰-tRNA到核糖体A位点。作者发现,eEF1A2的K408乳酰化并不改变其基础GTP酶活性,但在aa-tRNA刺激下,K408乳酰化状态下的eEF1A2催化效率显著提高。这表明,eEF1A2 K408乳酰化增加了其在aa-tRNA刺激下的GTP酶活性,可能促进了翻译延伸,从而增加了蛋白质合成。
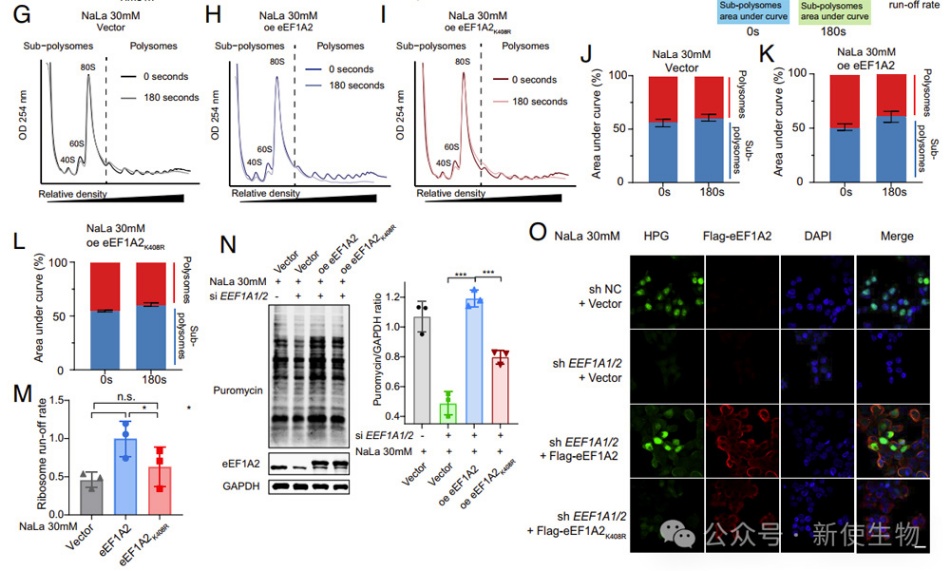
在细胞中重建了wt/delac-eEF1A2后,他们发现在乳酸钠存在下,delac-eEF1A2细胞中核糖体run-off减少了1.5倍,强调了eEF1A2K408la在维持肿瘤细胞中的延伸速率方面的重要性。
重建了wt-eEF1A2的细胞显示了比重建了delac-eEF1A2的细胞更高的蛋白质合成水平。这些结果表明,eEF1A2K408la促进了翻译延伸,增强了CRC细胞的蛋白质合成。
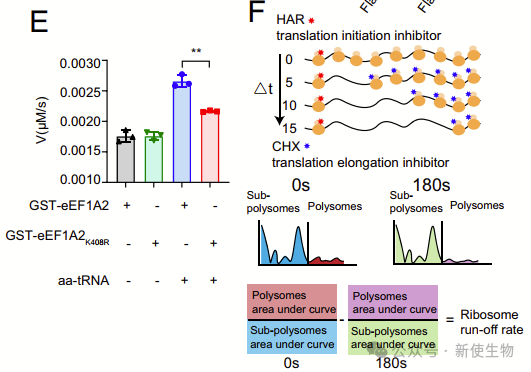
五. 确定KAT8为eEF1A2 K408的乳酰转移酶
作者通过质谱分析发现,KAT8是eEF1A2的潜在乳酰化调控因子。KAT8过表达导致eEF1A2的乳酰化水平显著增加,而KAT8敲除则减少了eEF1A2的乳酰化水平。免疫共沉淀实验显示,KAT8与eEF1A2有强烈的结合作用。
体外实验表明,KAT8直接介导了eEF1A2在K408位点的乳酰化。KAT8的敲除消除了eEF1A2的乳酰化增强蛋白质合成和肿瘤细胞增殖的差异。
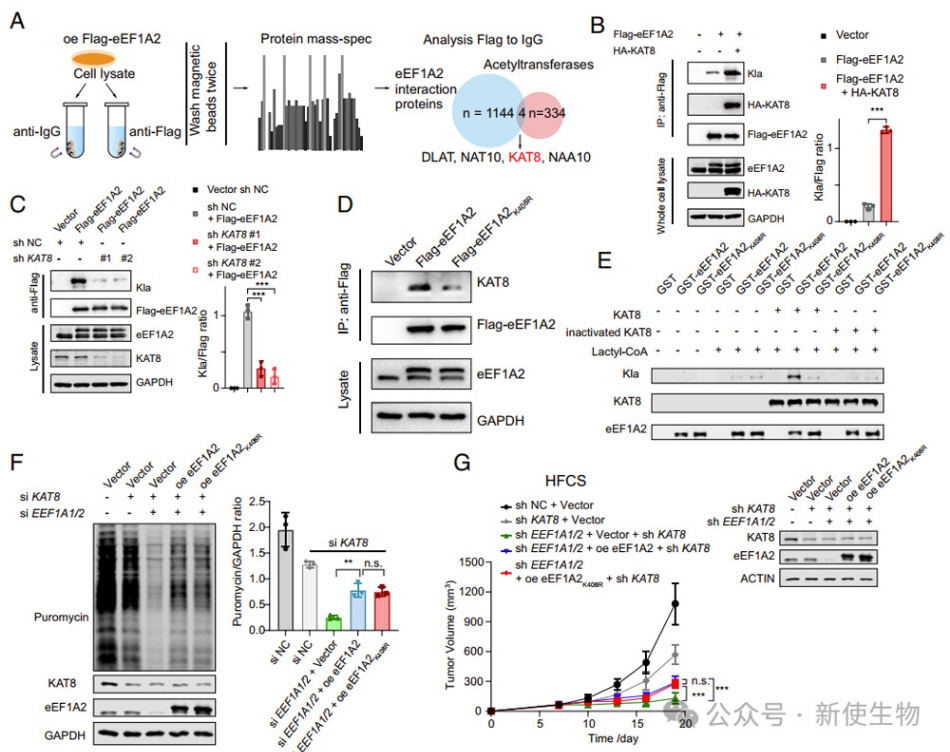
六. KAT8是全局蛋白质乳酰化的writer
KAT8是否是唯一的eEF1A2底物目前尚不清楚。作者消耗了KAT8并观察到CRC细胞中Kla显著减少,但乳酸水平保持不变。尽管KAT8被认为是一个乙酰转移酶,但发现在消耗KAT8后,非组蛋白中的赖氨酸乙酰化水平没有明显变化。
作者进一步发现,KAT8的MYST结构域对于其作为Kla赋码因子的活性是必需的。此外,KAT8的乳酰转移酶催化活性与其乙酰转移酶活性是独立的。

七. CRC细胞中KAT8调控的乳酰化组蛋白全景
KAT8调节结直肠癌细胞中丰富多样的乳酰化修饰。KAT8缺失显著降低了乳酰化位点,但未影响乳酸水平。
截短的KAT8实验证明其MYST结构域对乳酰化至关重要。乳酰化组学揭示了KAT8独特的靶蛋白,强调了KAT8在癌症通路中的作用。
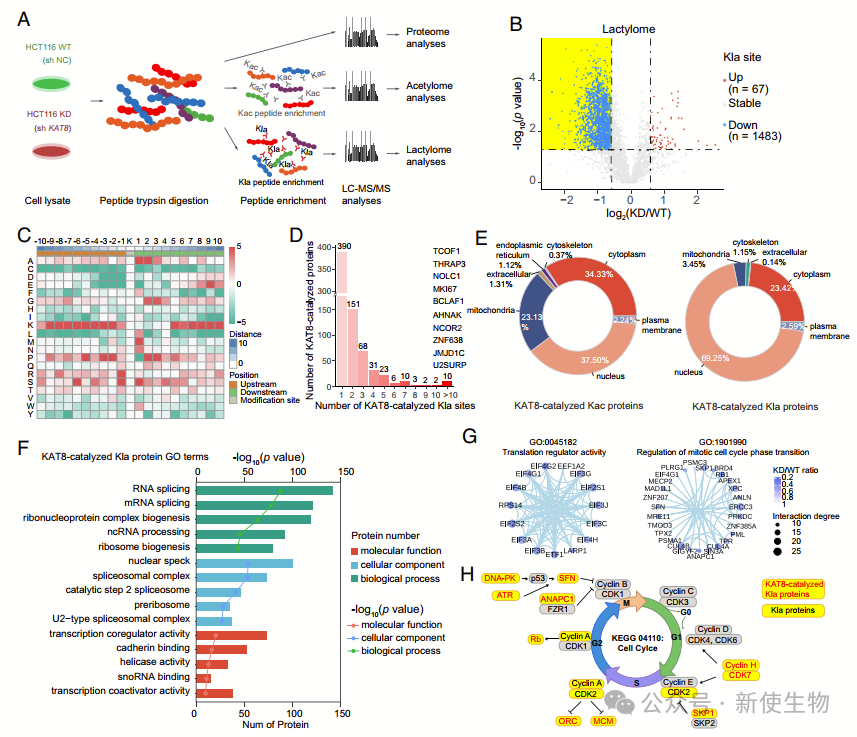
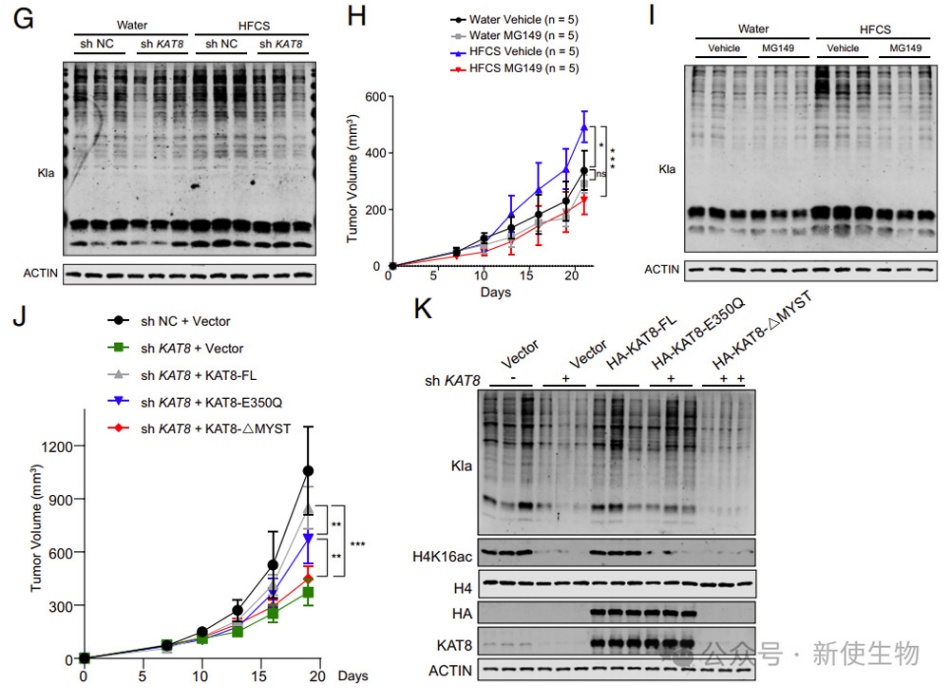
八. KAT8缺失抑制了高乳酸环境中的肿瘤生长
作者分析了CRC患者的免疫荧光染色,并发现高KAT8表达与患者生存期呈负相关,同时与CRC组织中的全局Kla水平呈正相关。KAT8缺失降低了HCT116细胞的Kla水平,并在高乳酸环境下减弱了细胞增殖。
裸鼠实验结果显示,KAT8缺失细胞在高乳酸环境下肿瘤生长减缓,全局Kla水平降低。他们推测KAT8的乳酰-催化区位于MYST结构域内,与其乙酰-催化结构域不同。综上所述,KAT8是CRC肿瘤发展的贡献者,尤其是在高乳酸环境下。

总结
本文发现CRC中全局Kla与患者预后呈负相关。在CRC中,eEF1A2K408的乳酰化导致了翻译延长和蛋白合成的增强,促进了肿瘤发生。通过筛选eEF1A2相互作用蛋白,文章确定了KAT8是一个关键的乳酰转移酶,负责在多种蛋白底物上安装Kla。KAT8的缺失抑制了CRC的肿瘤生长,尤其是在高乳酸环境中。因此,KAT8-eEF1A2 Kla轴可能成为治疗CRC的潜在靶点。
新使生物(neoribo)推出国内首款超高分辨率翻译组建库试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。


了解更多翻译组,polysome profiling联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们