导读
核糖体的经典作用是将遗传密码翻译成功能性蛋白质。然而,近期的发现重新定义了真核生物核糖体,将其视为一个能够感知细胞信号并向各种下游通路传递信息的调控中枢。
作为核糖体GTP酶相关中心(GAC)的一个组成部分,P-柄(P-stalk)曾被认为仅仅是翻译过程的支持者,但现在正逐渐被揭示为一个关键的调控模块。近期研究发现,P-柄是整合应激应答(ISR)通路的一个激活剂,将经典的Gcn1/Gcn20 → Gcn2激活轴重塑为Gcn1/Gcn20/P-柄 → Gcn2的新模式。
其结构的可塑性也使得核糖体能够根据细胞需求(如细胞因子应答)来重塑基因表达。此外,P-柄组分还具有独立于核糖体的“兼职”功能。
2025年10月7日,波兰玛丽亚·居里-斯克沃多夫斯卡大学的Marek Tchórzewski教授团队在Trends in Cell Biology杂志发表了题为“The promiscuous ribosomal P-stalk: a new functional portrait”的综述文章。该文提出了P-柄的一个更新的功能画像,涵盖了其依赖于核糖体的经典功能和不依赖于核糖体的非经典功能。

综述整理
一、重新定义核糖体:从“蛋白质生产者”到“主调控者”
传统观点认为,核糖体是一个被动的“蛋白质生产者”。然而,越来越多的证据表明,核糖体远不止于此:它能感知代谢线索,整合胁迫信号,并协调选择性的蛋白质组重塑。
在这一新范式中,核糖体GTP酶相关中心(GAC)及其在真核生物中的特有蛋白实体——P-柄,扮演着核心角色。P-柄赋予了核糖体卓越的结构可塑性,使其能够与多种经典和非经典伴侣蛋白相互作用,成为连接翻译与细胞信号的关键节点。
核糖体异质性(ribosomal heterogeneity)和特化核糖体(specialized ribosomes)概念的出现,进一步支持了核糖体的主动调控作用。细胞可以根据生理或病理状态,通过改变核糖体的组成(如核糖体蛋白的亚型、修饰或化学计量比),来选择性地翻译特定的mRNA。P-柄的组成变化是核糖体异质性的一个重要来源。
二、P-柄的经典功能:翻译过程的GTP酶激活中心
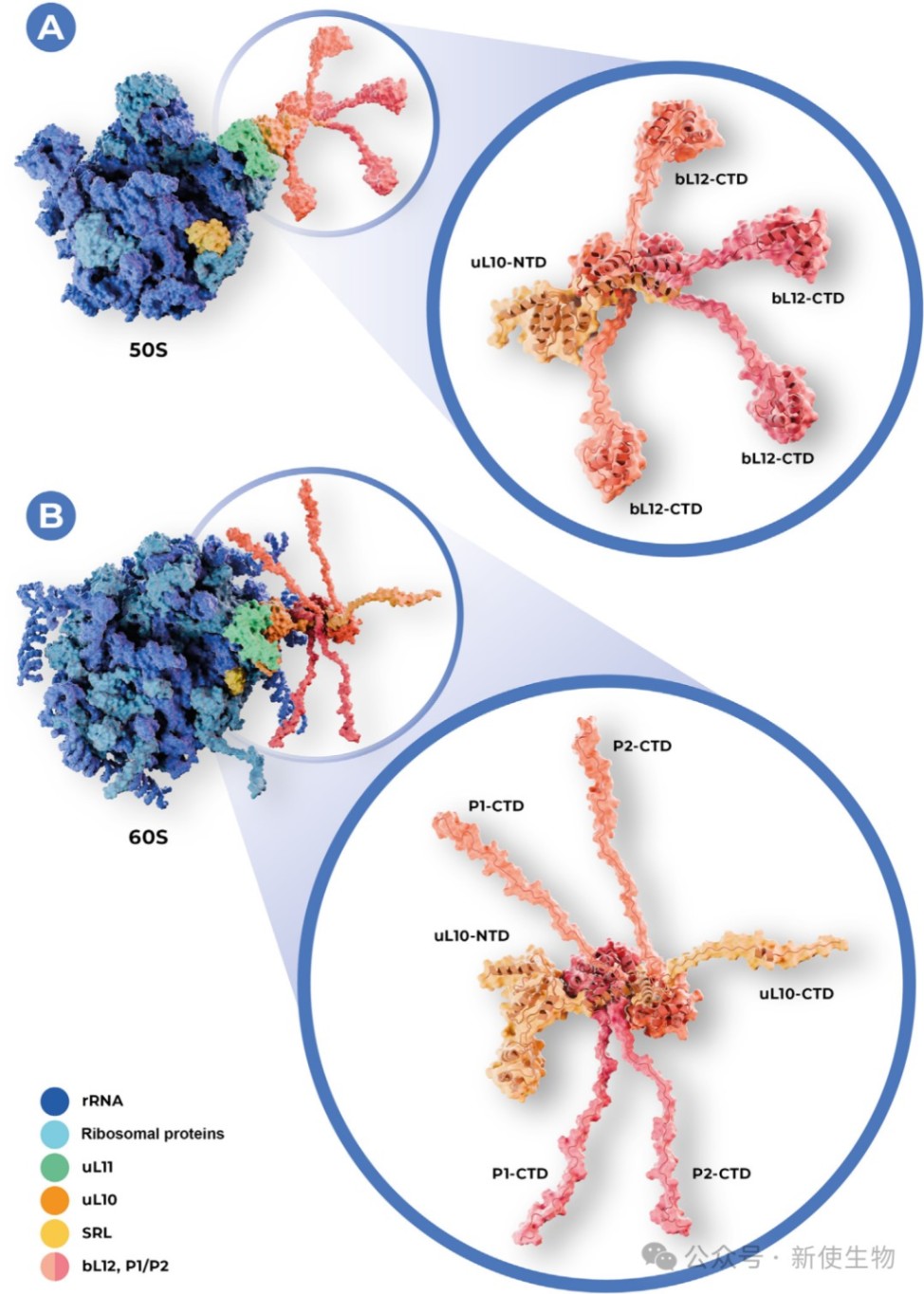
GAC是核糖体大亚基上的一个功能中心,负责结合并激活一系列翻译GTP酶(trGTPases),从而驱动核糖体沿mRNA单向运动。GAC由rRNA组分sarcin-ricin环(SRL)和蛋白组分(uL11、uL10以及P-柄蛋白)构成。
2.1) P-柄的结构与组成:
真核生物的P-柄由一个uL10蛋白和两个P1-P2异二聚体构成,形成一个五聚体复合物uL10(P1-P2)₂。P蛋白的N端负责二聚化并锚定在uL10上,而其C端则是一段内在无序区(IDR)。P-柄通过这五个灵活的C端IDR触手,与trGTPases相互作用。
2.2) P-柄的双重作用:
1. 停泊平台:为trGTPases(如eEF1A、eEF2)提供结合位点,增加其局部浓度。
2. GTP酶激活:与SRL协同,促进trGTPases水解GTP,为翻译过程提供能量和方向性。
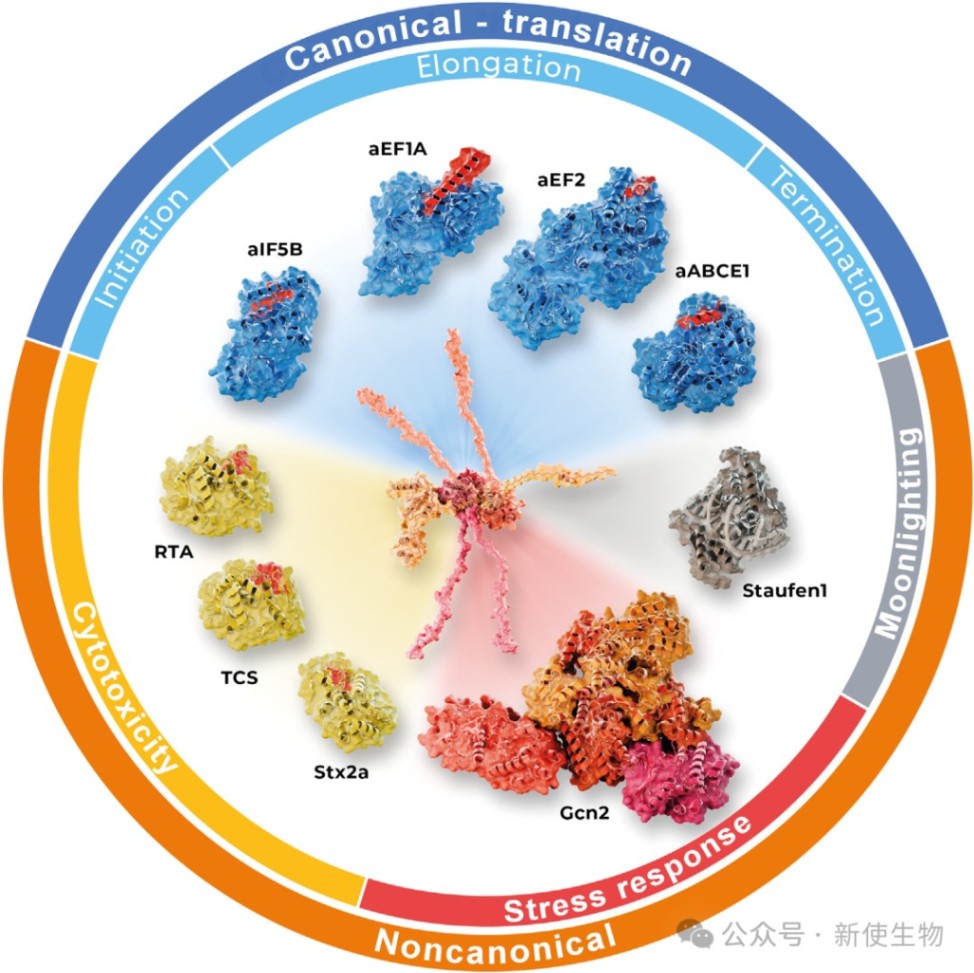
三、P-柄的混杂特性:非经典相互作用与新功能
P-柄的C端IDR赋予了其卓越的结合可塑性,使其不仅能结合经典的trGTPases,还能与一系列非经典伴侣蛋白相互作用,从而解锁了超越翻译本身的新功能。
3.1) P-柄与整合应激应答(ISR)
ISR是真核生物中一个核心的适应性通路。近期突破性研究发现,P-柄是ISR核心激酶Gcn2的直接激活剂。
1. 核糖体碰撞作为信号:当细胞面临营养匮乏等胁迫时,核糖体会在mRNA上发生停滞和碰撞。这种碰撞事件作为一个分子信号,被细胞感知。
2. P-柄激活Gcn2:P-柄作为核糖体上的主要结合平台,直接与Gcn2激酶相互作用。这种相互作用能够将Gcn2从自抑制状态中释放出来,从而激活ISR通路。
3. 重塑经典通路:这一发现将经典的“脱酰tRNA → Gcn1/Gcn20 → Gcn2”激活模型,修正为以核糖体为中心的“Gcn1/Gcn20/P-柄 → Gcn2”新模型,将P-柄定位为ISR感知的核心触发器。P-柄的C端IDR数量与其激活Gcn2的效率成正比,凸显了其多价相互作用的重要性。
3.2) P-柄与细胞毒性
P-柄的混杂性也被一些生物毒素所利用。核糖体失活蛋白(RIPs),如蓖麻毒素和志贺毒素,通过特异性结合P-柄的C端,将自己引导至SRL附近,然后对SRL进行脱嘌呤修饰,从而抑制翻译并引发细胞毒性应答。
3.3) P-柄的组成重塑与特化翻译
P-柄的组成不是一成不变的。在细胞因子(如TNFα)刺激下,细胞会形成一类P-柄组分更完整的特化核糖体,这些核糖体选择性地翻译与免疫监视相关的mRNA。这表明,通过重塑P-柄的化学计量比,细胞可以根据外界信号调整其蛋白质组,实现精准的翻译重编程。
3.4) P-柄的“兼职”活动:超越核糖体的功能
P-柄的组分(特别是uL10蛋白)可以从核糖体上解离下来,在细胞的其他区域执行独立于翻译的“兼职”功能。最新研究发现,在DNA双链断裂(DSB)后,uL10会从细胞质转移到细胞核,参与到DNA损伤应答(DDR)中。它通过与核仁旁斑的核心蛋白NONO结合,促进DNA修复,并影响肿瘤细胞的放射抗性。
结论与展望
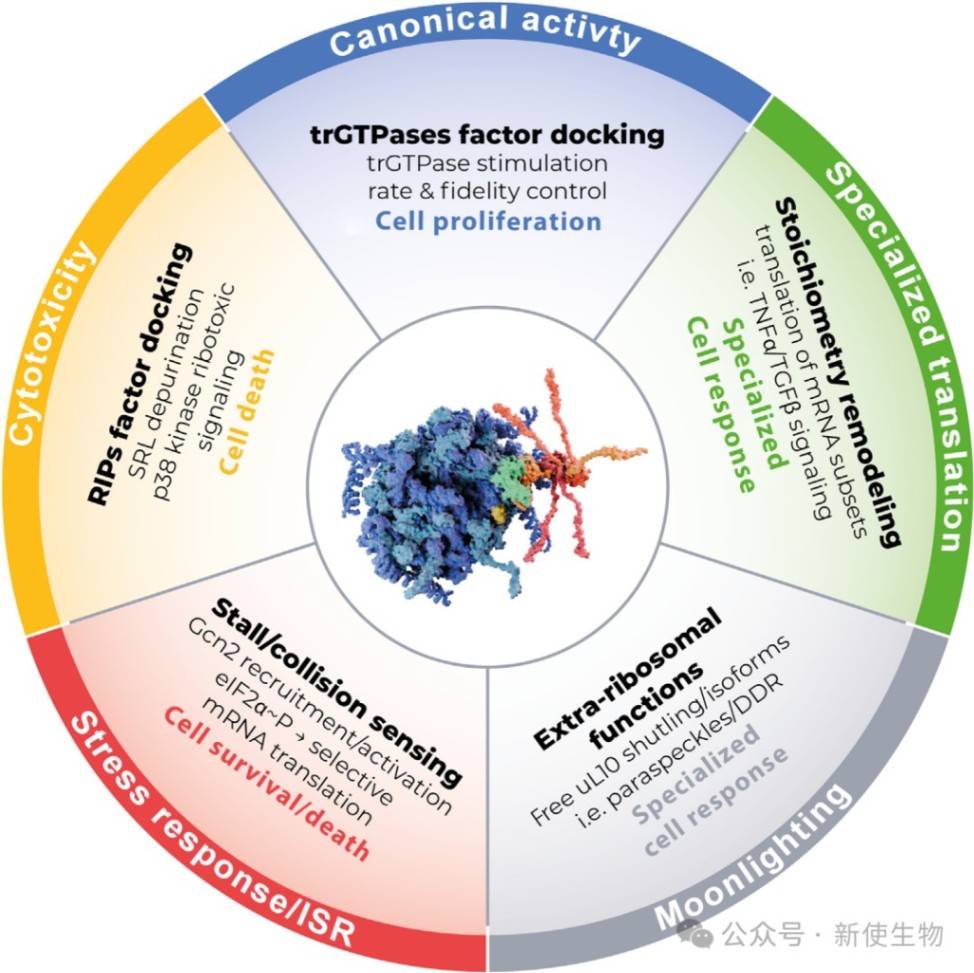
P-柄已从一个简单的翻译辅助元件,转变为一个功能多样的信号整合中枢。它混杂的结合特性、在ISR中的核心传感作用、可变的组成以及广泛的兼职活动,共同描绘了一幅远超经典的全新功能图谱。
未来,结合时间分辨冷冻电镜、结构蛋白质组学和翻译组学等前沿技术,将有望捕获P-柄的动态变化,并将其与功能输出精确关联。全面理解P-柄的工作模式,不仅将深化我们对生命基本过程的认识,也为癌症、感染和神经退行性疾病等病理状态的诊断和治疗开辟了全新的靶点和策略。
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com。
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们