导读
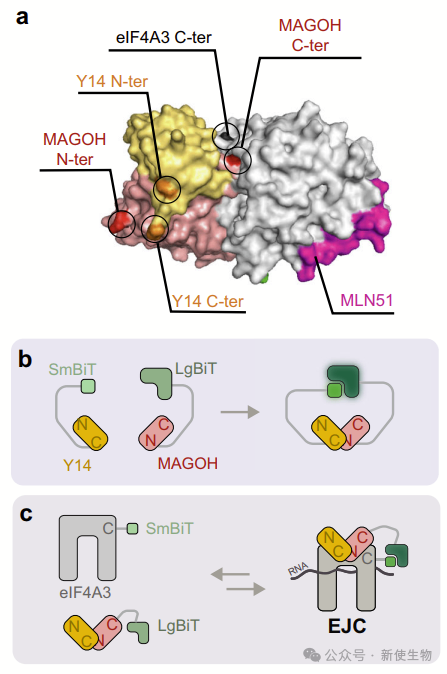
外显子连接复合物(EJC)是存在于真核生物中的多蛋白复合物。它们由三个核心蛋白eIF4A3/DDX48、MAGOH和Y14/RBM8A组成,并与多个辅助伙伴相互作用。
EJC主要通过激活带有早终止密码子(PTC)且位于最后一个内含子之前转录物的无义介导降解(NMD)来参与mRNA质控。此外,EJC还影响可变剪接、转录物核输出、翻译效率和抑制mRNA的m6A甲基化。
EJC在外显子-外显子连接处由剪接体组装,这是一个在snRNA和蛋白质组成上经历广泛变化的RNA/蛋白质结构。根据模型,EJC在mRNA输出到细胞质的过程中伴随mRNA,随后第一个翻译的核糖体将其推出,如果EJC没有被移除,它们会招募NMD因子并激活转录产物降解。
EJC也可以通过某些非翻译依赖机制被移除,并且NMD可以独立于EJC发生。然而,EJC的组装和解离的动态过程如何影响翻译调控,具体细节尚不清楚。
2024年5月17日,法国IBENS研究所Hervé Le Hir团队在Nature Communications上发表了一篇题为“Exon-junction complex association with stalled ribosomes and slow translation-independent disassembly”的论文,文章使用NanoBiT分裂荧光素酶系统监测EJC核心亚基Magoh和eIF4A3的相互作用,测量及评估翻译依赖和非翻译依赖的EJC解离机制,并揭示了EJC与核糖体的稳定关联。

文章索引
【标题】Exon-junction complex association with stalled ribosomes and slow translation-independent disassembly
【发表期刊】Nature Communications
【发表日期】2024年5月17日
【作者及团队】法国IBENS研究所Hervé Le Hir团队
【IF】16.6
研究结果
一. 工程化EJC-NanoBiT
作者使用NanoBiT蛋白互补检测系统研究EJC解离。NanoBiT将纳米荧光素酶分为LgBiT和SmBiT两个片段,分别融合到目标蛋白的N端或C端。
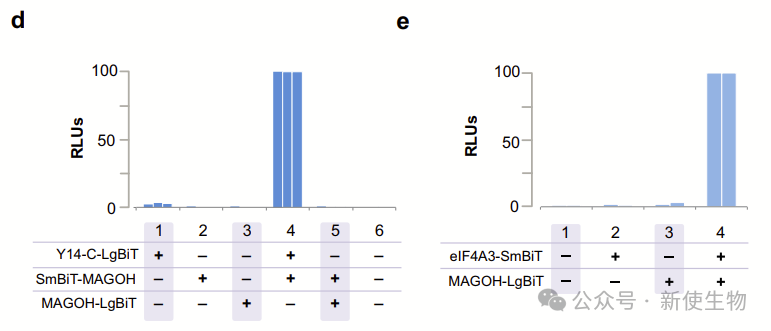
EJC核心由eIF4A3、MAGOH和Y14组成。团队将SmBiT和LgBiT分别融合到MAGOH的C端和Y14的N端,共同转染的细胞显示出高荧光素酶活性。
为了检测EJC组装,他们将SmBiT和LgBiT分别融合到eIF4A3和MAGOH的C端,结果也显示出高荧光素酶活性,表明EJC成功组装。
二. 影响EJC形成的突变也会削弱EJC-NanoBiT活性
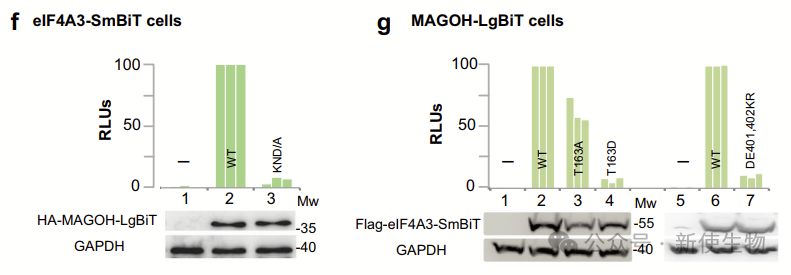
作将野生型和缺陷型MAGOH或eIF4A3突变体分别与对方共表达,突变体的荧光素酶活性显著降低,这表明荧光素酶活性反映了EJC NanoBiT复合物的形成。
最终,他们在HEK293细胞中建立了共表达野生型MAGOH-C-LgBiT和eIF4A3-C-SmBiT的稳定细胞系。
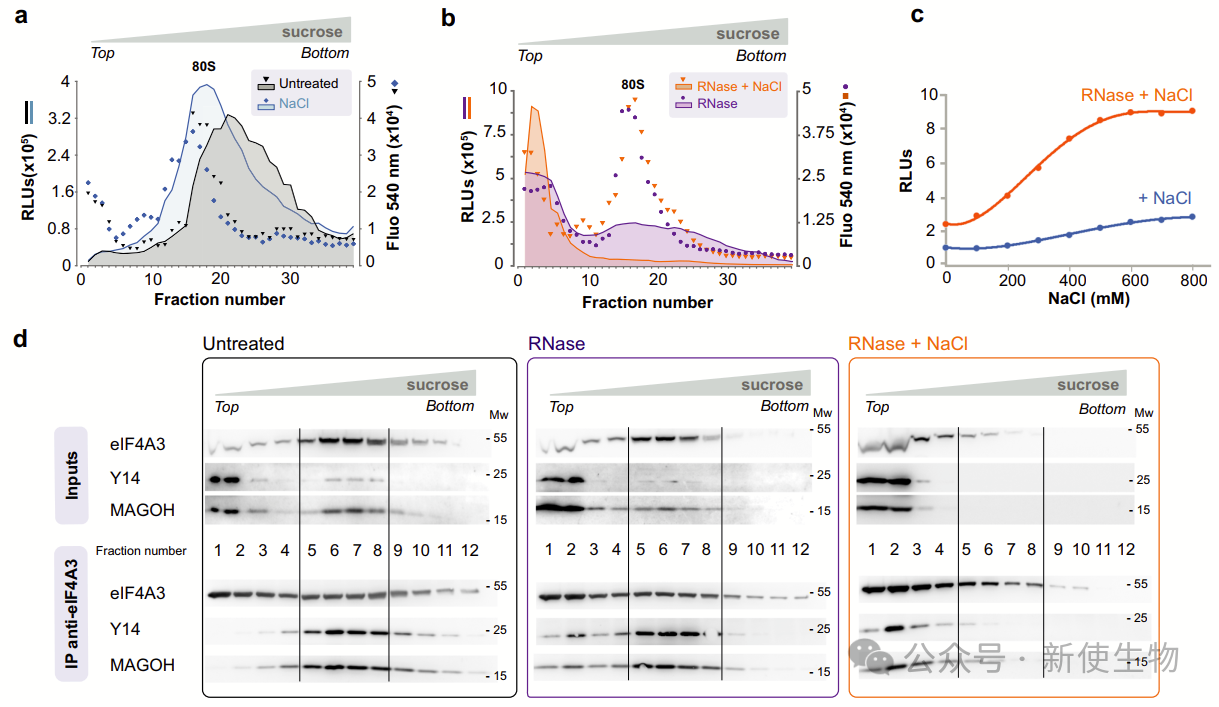
三. EJC颗粒非常大,含有核糖体
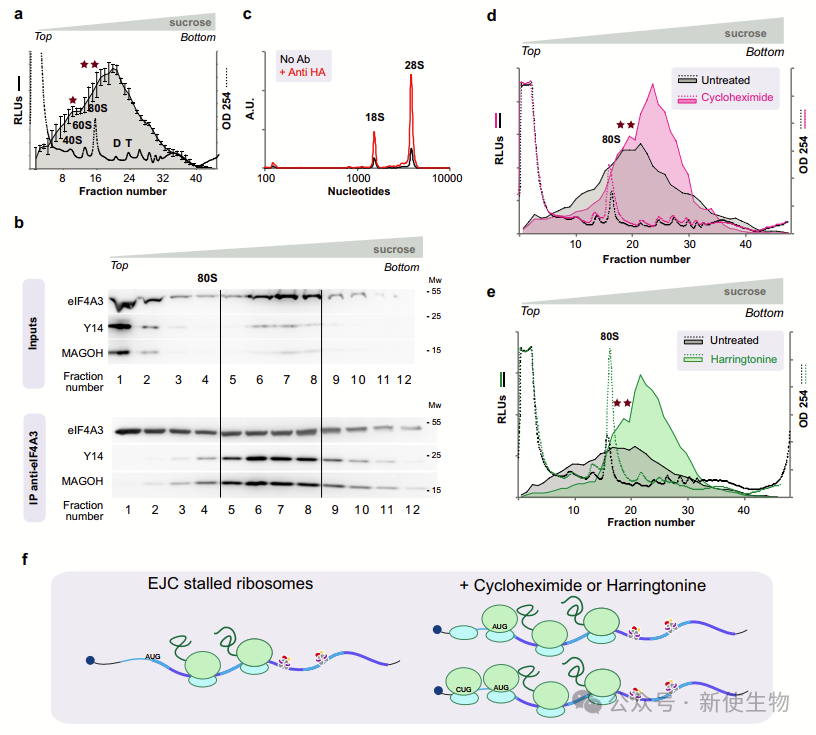
为了研究EJC-NanoBiT颗粒,作者从表达细胞中提取低离子强度提取物,通过蔗糖梯度超速离心分级。荧光素酶活性分布在大多数级分中,峰值在双体大小,未经标记的EJC也显示相似的分布,大部分EJC核心蛋白未组装。
EJC颗粒的平均大小非常大,表明其含有多个核糖体。通过免疫沉淀发现18S和28S核糖体RNA,这确认了EJC相关的mRNP中包含核糖体。
用翻译抑制剂处理细胞后,EJC颗粒的平均大小显著增大,这表明翻译抑制剂会增加EJC相关mRNP中的核糖体数量。总体而言,停滞的核糖体导致了EJC颗粒的巨大尺寸。
三. 增加离子强度能缓解EJC-核糖体颗粒的限制
在高盐和RNase条件下,大型NanoBiT EJC颗粒消失,而荧光素酶活性显著增加,表明增加离子强度促进了EJC的RNase消化和EJC-NanoBiT荧光素酶活性。
在分级实验中,EJC核心亚基在梯度顶部和中部分级中发现,但共免疫沉淀只在中部分级中观察到。增加离子强度和RNase处理显著改变了共免疫沉淀的分布,但EJC核心仍然保持组装状态。
四. EJC解体经由快速翻译依赖途径和缓慢翻译非依赖途径发生
作者研究了EJC解体的动态过程,直接在细胞裂解液中测量NanoBiT的活性。荧光素酶活性在细胞培养几小时后保持稳定,表示EJC组装和解体达到了平衡。当转录被抑制时,EJC的活性随着时间的推移而降低,这表明EJC被解体。
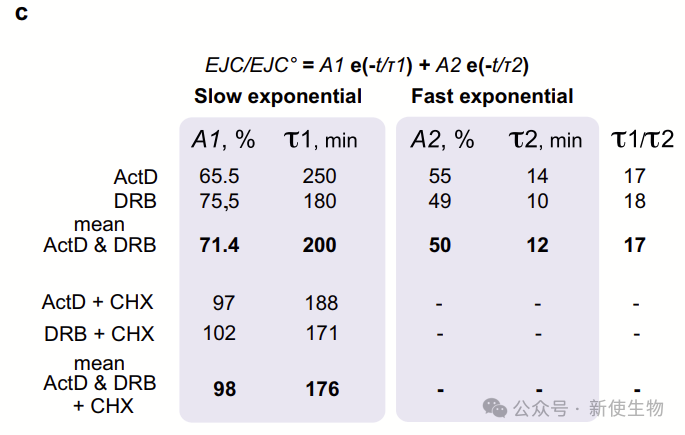
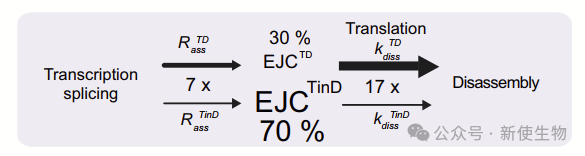
进一步分析显示,依赖于翻译的EJC解体速度比翻译无关的速度快15倍以上,而且仅涉及稳态下31%的EJC。
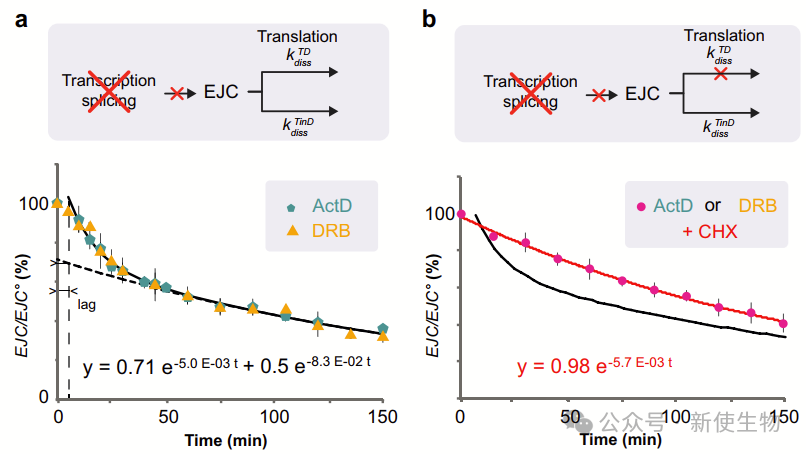
五. 易于依赖翻译解体的EJC组装也是一个快速的过程
研究团队想了解新沉积的EJC是否更可能通过翻译依赖(TD)或翻译非依赖(TinD)的方式进行解体。在稳态下,尽管组装速度更快,但“不稳定”的EJC积累较少,因为它们的解离速度比“稳定”的EJC快得多。
令人矛盾的是在稳态下,大多数新沉积的EJC很可能通过快速的翻译依赖过程进行解体。EJC从mRNA中的去除已被认为同时遵循依赖于翻译和独立于翻译的机制。
六. 在恢复转录后观察EJC的组装
添加翻译抑制剂后,裂解液中的荧光素酶活性增加,30分钟内达到了平台期。
转录恢复后,荧光素酶活性迅速增加。分析显示,存在环丙沙星时的恢复速度比没有环丙沙星时快3.4倍,这表明转录是EJC组装的必要条件,但这一过程并不需要新的蛋白质合成。
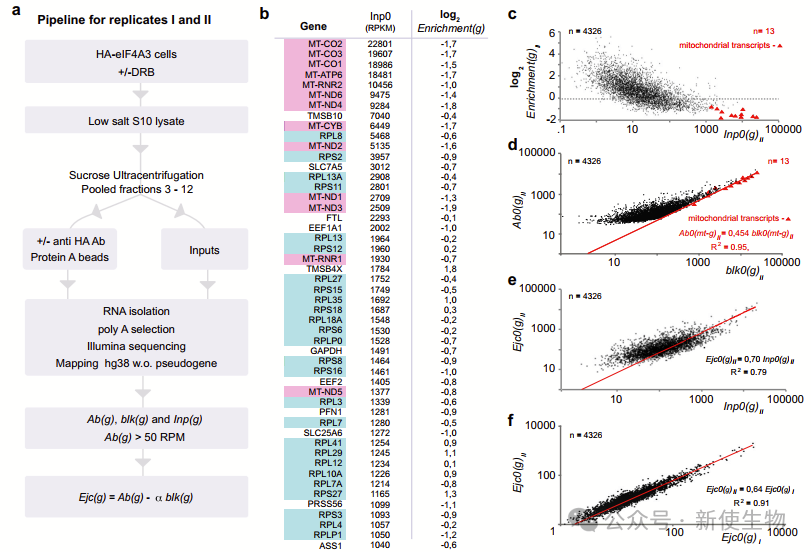
七. RIP-测序是EJC结合转录本的研究方法
研究团队通过对人真核翻译起始因子eIF4A3基因进行N-末端HA标记,建立了细胞系。经过筛选,获得了4326个符合条件的基因,这些基因中的3/4在免疫沉淀物中富集。
利用线粒体基因编码的转录本,评估EJC结合转录本的“真实”数量。分析两个生物学重复的数据后发现,EJC结合转录本的读数存在一定的相关性。
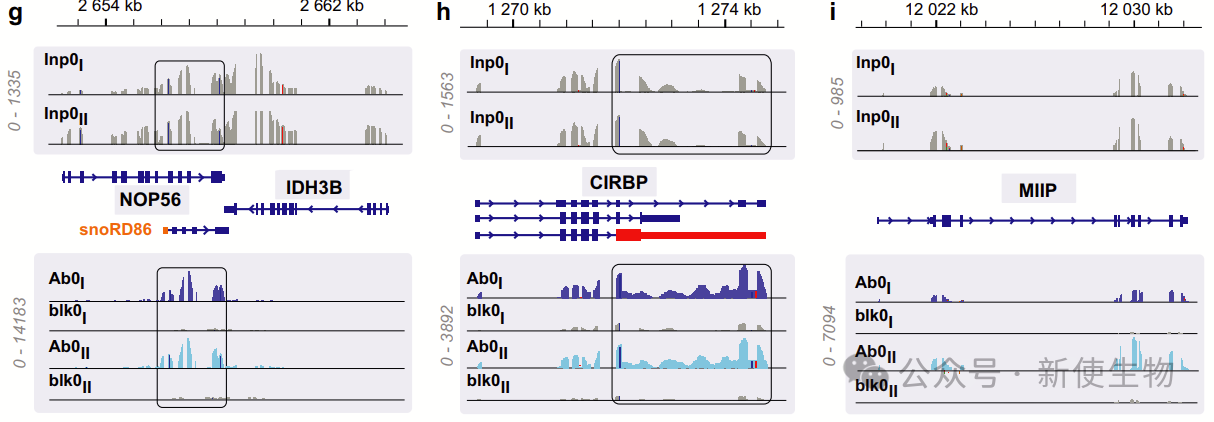
八. 与EJC的转录特异性结合
作者系统地检查了546个基因,它们平均显示出4倍以上的富集,因此明确地与EJC结合。
他们对两个生物学重复中最丰富的50个基因进行了系统检查,对比了免疫沉淀(Ab0)和空白(blk0)的轨迹。一些典型的例子展示了相邻基因之间的不同特征,以及EJC结合转录本与输入转录本之间的差异。
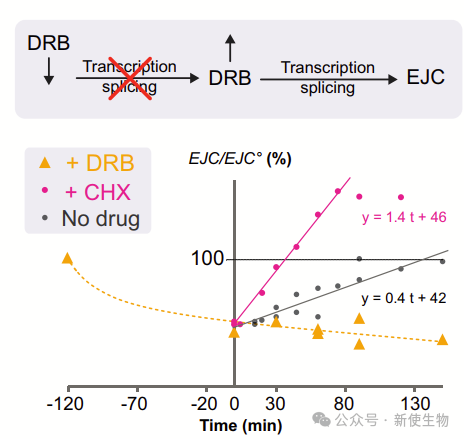
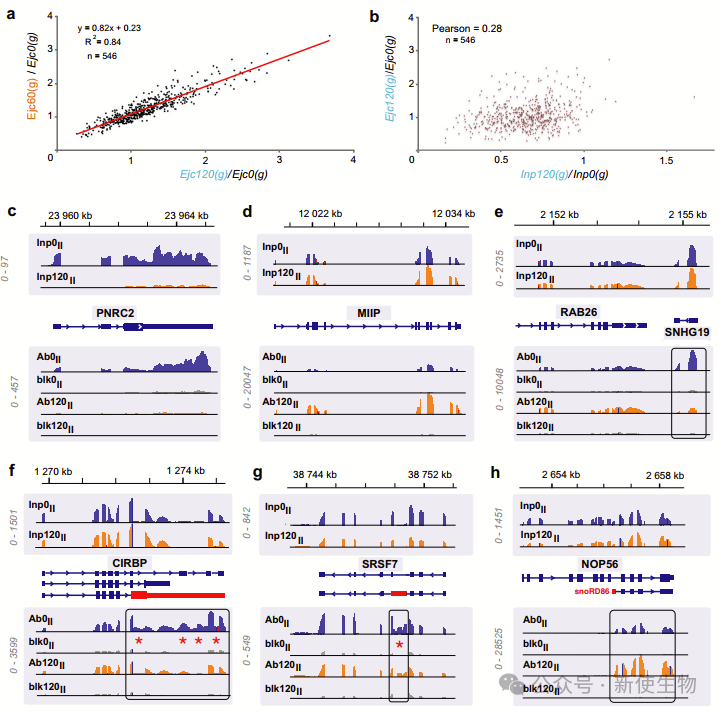
九. EJC与特定转录本的持久性
作者测试了转录停滞后与EJC结合的转录本的持久性。他们观察了未经处理和经过不同时间DRB处理后的Ejc(g)变化,结果显示了转录本持久性的差异。这表明,EJC-RNA复合物的寿命与转录本相关,并且EJC富集在转录本中存在一定的偏倚。
总结
EJC是剪接过程中沉积在外显子-外显子连接处的复合物,主要用于激活携带过早终止密码子的转录本的降解。本文研究发现,这些复合物与核糖体稳定关联,85%的新沉积EJC通过依赖于翻译的机制解组,揭示了EJC与核糖体的稳定关联。
新使生物(neoribo)推出国内首款超高分辨率翻译组建库试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。


了解更多核糖体分析联系新使生物


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们