导读
造血干细胞(HSCs)是骨髓中罕见的成体干细胞,具有自我更新和多向分化能力,终身维持血细胞生成。为了应对复制、代谢、氧化和基因毒性等各种压力,HSCs发展了多种适应机制,但其完整适应机制仍未完全理解。
HSCs经历快速的静止状态打破、大规模克隆扩增和分化,这对于有效的造血重建至关重要。为满足巨大的生物能和生物合成需求,HSCs在转录、转录后和翻译水平快速增加蛋白质合成。
mTOR通路在这些过程中发挥重要作用,并被确定为调控HSC功能的关键因子,然而,mTOR通路在翻译调控水平上的调控研究较少。
长期以来,人们认为tRNA通过结构与mRNA密码子相互作用影响翻译。哺乳动物tRNA高度修饰,其化学修饰对翻译起重要作用,其中N1-甲基腺苷(m1A)修饰由TRMT61A和TRMT6催化,可以增强翻译起始和延伸。然而,TRMT6/TRMT61A在HSCs中的生物学功能尚不明确。最近有研究表明,TRMT6-TRMT61A复合物通过tRNA-m1A58修饰促进HSC老化。
2024年7月8日,杭州师范大学医学院汪虎团队在Nature Communications上发表了一篇题为“tRNA m1A modification regulate HSC maintenance and self-renewal via mTORC1 signaling”的论文,研究发现了tRNA-m1A58甲基转移酶TRMT6/TRMT61A作为mTOR通路的翻译调控点,对维持HSC内稳态和快速合成特定关键功能蛋白质以促进HSC分化和自我更新具有重要作用机制。

文章索引
【标题】tRNA m1A modification regulate HSC maintenance and self-renewal via mTORC1 signaling
【发表期刊】Nature Communications
【发表日期】2024年7月8日
【作者及团队】杭州师范大学医学院汪虎团队
【IF】16.6
研究结果
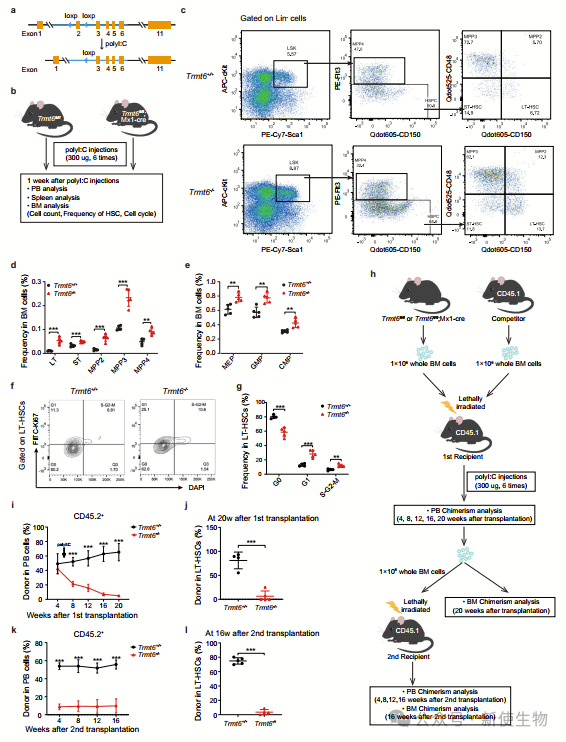
一. Trmt6缺失导致HSC表型扩增和长期再生能力下降
在研究Trmt6和Trmt61a在造血系统中的功能前,作者利用单细胞转录组数据评估了这些基因的表达。Trmt6在移植后及5-Fu、辐射或LPS处理后上调。
生成的Trmt6敲除小鼠(Trmt6-/-)显示B淋巴细胞减少,髓系细胞增加,白细胞和淋巴细胞减少,血小板和中性粒细胞增加。
流式分选显示,Trmt6-/-小鼠的造血干细胞(HSCs)频率增加,但静止状态减少。5-Fu处理后,Trmt6-/-小鼠存活时间显著减少,表明其HSCs更易耗尽。竞争性移植实验显示,Trmt6-/- HSCs的长期重建能力降低约10倍。这些结果都表明,Trmt6缺失显著损害了HSCs的长期重建和自我更新能力。
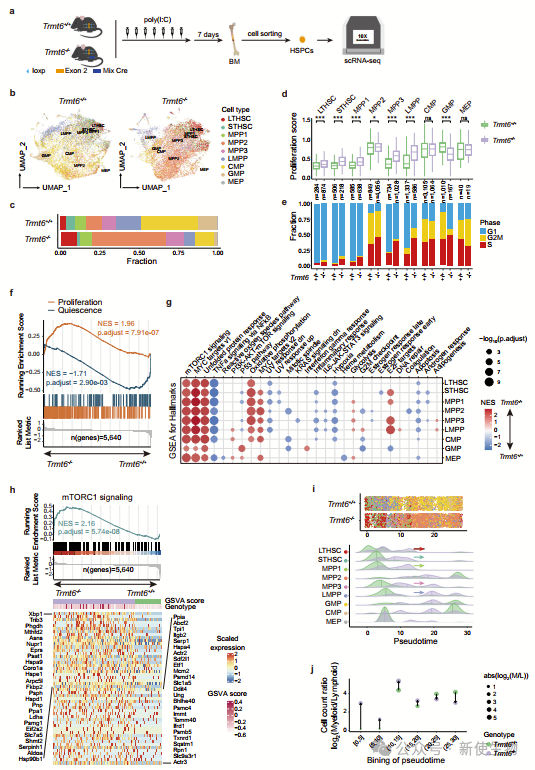
二. 单细胞测序显示Trmt6缺失的造血干细胞群体中mTORC1信号通路被激活
为了阐明Trmt6在造血中的分子机制,作者对Trmt6+/+和Trmt6-/-小鼠骨髓中的HSPCs进行了单细胞RNA测序(scRNA-seq)。结果显示,Trmt6-/- HSPCs中LT-HSCs和MPP2比例增加,而其他细胞类型比例减少,显示出更高的增殖评分和S/G2/M细胞周期标志。
基因富集分析显示,Trmt6-/- HSPCs中mTORC1信号、未折叠蛋白反应和MYC靶标等基因集的表达更为活跃。时间分析表明,Trmt6-/-小鼠的HSCs在转录组上倾向于髓系转变。
总结来说,单细胞转录组分析显示,Trmt6在HSC静止和增殖转换中起重要作用,通过调控mTORC1信号通路。
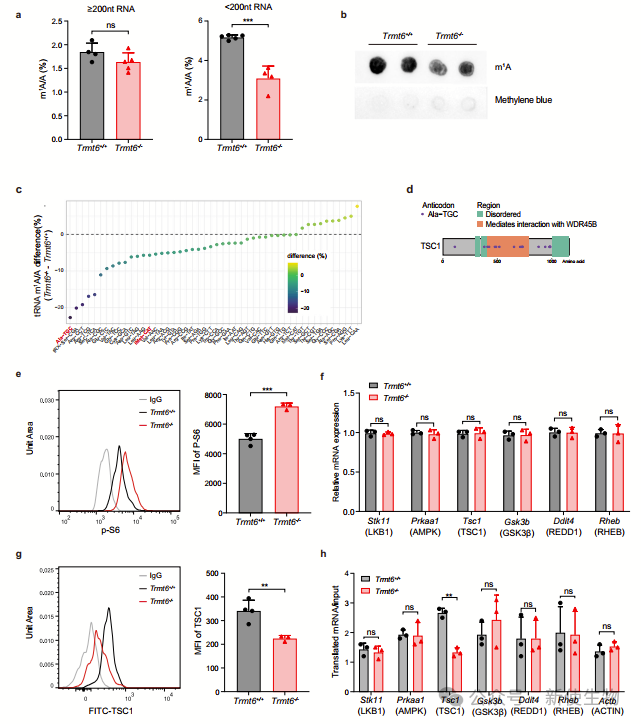
三. tRNA-m1A58修饰对Tsc1 mRNA高效翻译和mTORC1信号调控是必需的
单细胞RNA测序结果显示,Trmt6-/- HSPCs中,LT-HSCs和MPP2细胞增多,其他细胞类型减少。这些细胞表现出增强的增殖特征和细胞周期的S、G2/M阶段增加,表明Trmt6-/- HSCs的静止-增殖转换受到干扰。
基因表达分析显示,Trmt6缺失影响了411个基因在LT-HSCs中的表达,涉及到增殖和静止相关基因集的调控。
作者利用Ribo-seq核糖体印迹分析技术,发现Trmt6-/- HSPCs中tRNA-m1A58修饰水平显著降低,导致Tsc1 mRNA翻译效率下降,进而引发mTORC1信号通路的激活。
作者通过实验证实,tRNA-m1A58修饰通过密码子解码直接调控Tsc1 mRNA翻译。敲低TRMT61A表达产生的类似效应进一步证明了tRNA-m1A58修饰在此过程中的重要作用。
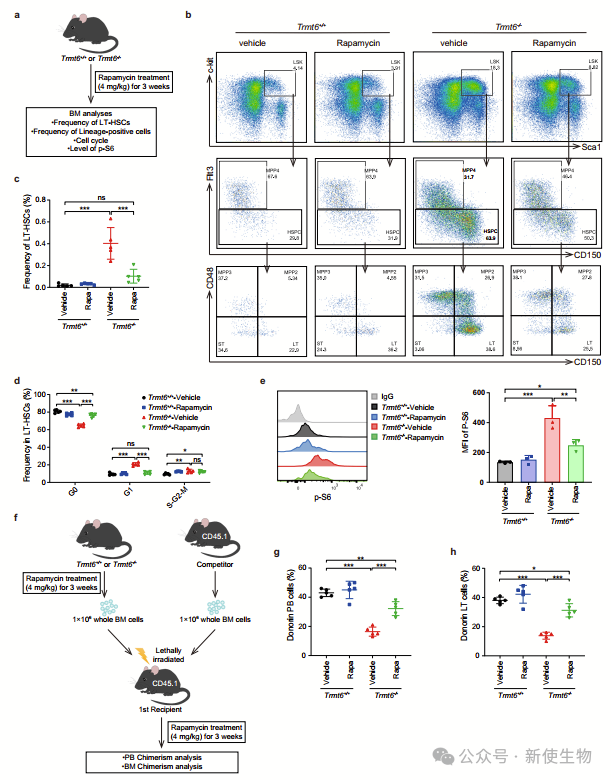
四. 抑制mTOR通路改善了Trmt6敲除造血干细胞的异常增殖和自我更新缺陷
雷帕霉素治疗可以部分恢复Trmt6-/-小鼠中失调的造血过程。这项研究显示,雷帕霉素减少了LT-HSCs、ST-HSCs、MPPs和多种血细胞的异常增生,并改善了细胞周期缺陷。
进一步实验证明,过表达TSC1可部分修复Trmt6-/- HSCs的功能,提示mTORC1信号通路的过度激活在这一过程中起到了关键作用。
总结
本研究揭示了tRNA m1A58修饰的写入蛋白TRMT6和TRMT61A在造血干细胞中的作用。Trmt6缺失导致HSC异常增殖,通过激活mTORC1信号通路。Trmt6缺失后HSC富集细胞中mTORC1信号通路显著上调,TRMT6通过促进特定tRNA的甲基化修饰和TSC1的表达来调节mTORC1信号水平。药物抑制mTORC1信号通路可以部分恢复Trmt6缺失HSC的功能缺陷。
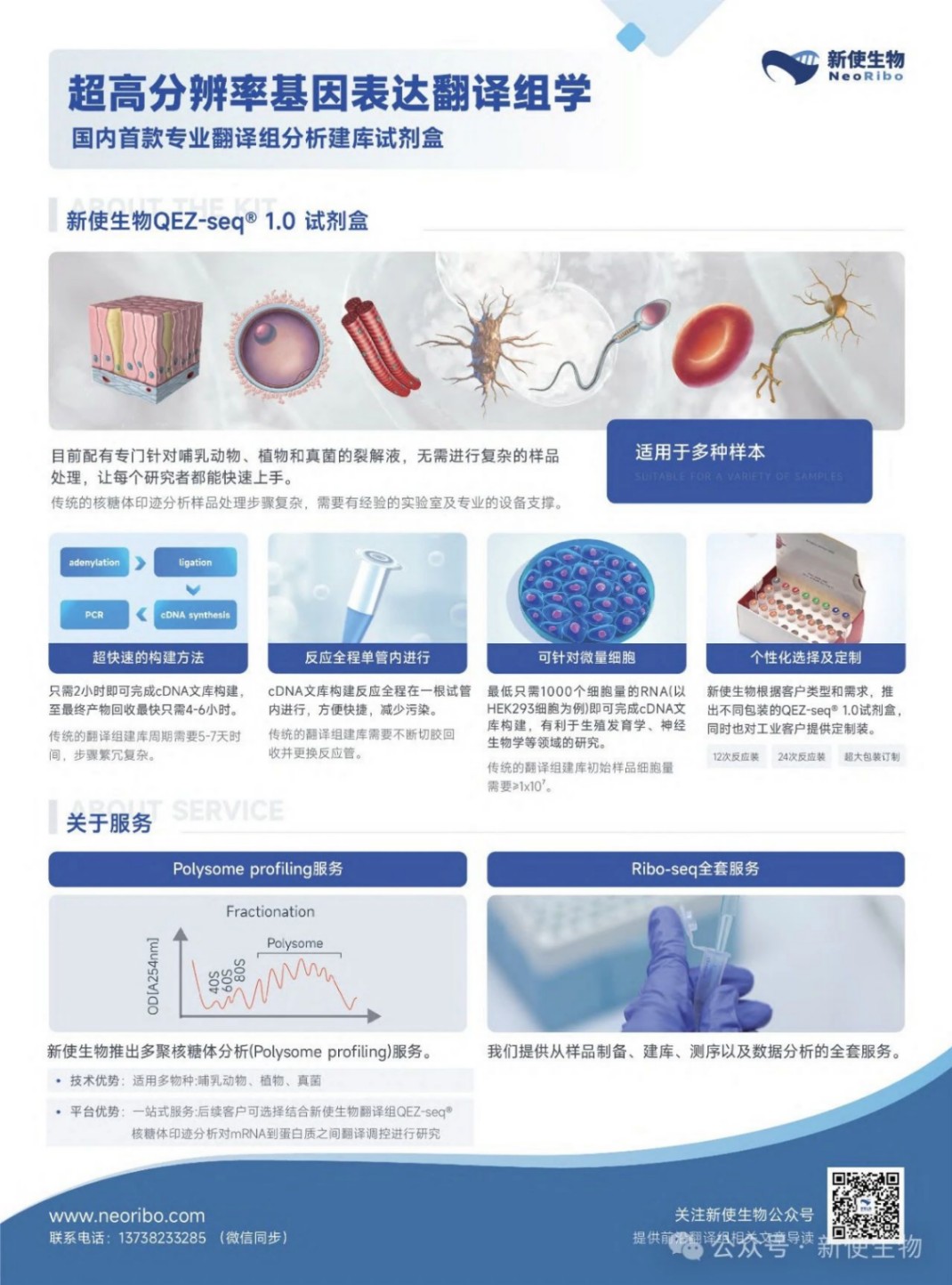
新使生物(neoribo)推出国内首款超高分辨率翻译组ribo-seq建库试剂盒。
我们的核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息杭州新使生物
点击下图可查看详情:

关注新使生物,了解更多翻译组测序前沿信息


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们