导读
m6A(N6-甲基腺苷)是mRNA中的主要修饰,涉及发育、免疫激活和细胞应对压力。m6A通过影响转录、RNA处理、核-质转运、降解和翻译来调节mRNA,通常发生在mRNA的3' UTR和长内含子上,与3' UTR长度正相关。
尽管有研究显示m6A可能抑制近端聚腺苷酸化位点(pPAS)的使用,但大多数m6A修饰实际发生在短3' UTR的mRNA上,提示它可能促进pPAS的使用。
m6A由METTL3-METTL14复合体催化,FTO和ALKBH5可逆转其修饰。转录因子CEBPZ和SMAD2/3,以及RNA聚合酶II(RNA Pol II)和H3K36me3组蛋白修饰,参与m6A的全局调节。
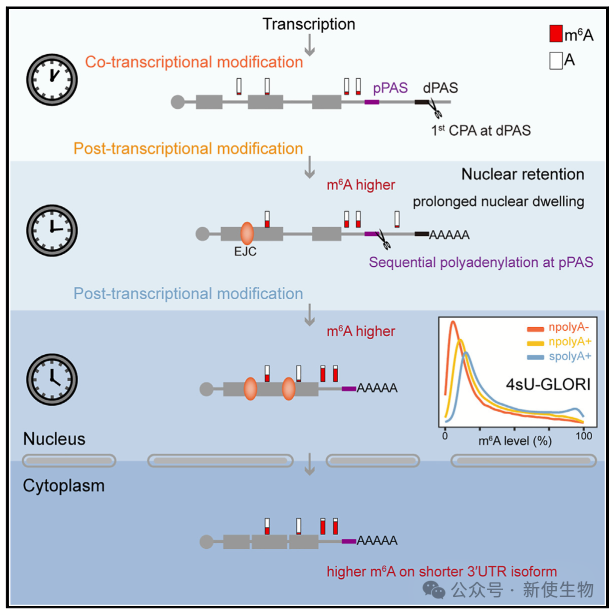
最近的研究显示,m6A主要在转录后增加,与新的逐步聚腺苷酸化模式有关,即远端PAS(dPAS)上的聚腺苷酸化mRNA可以在核出口前进一步在近端PAS(pPAS)得到处理,这些发现有助于解决m6A修饰在转录过程中还是转录后发生的问题。
024年8月9日,武汉大学生命科学学院周宇团队在Molecular Cell上发表了一篇题为“Nuclear retention coupled with sequential polyadenylation dictates post-transcriptional m6A modification in the nucleus”的论文,开发了4sU-coupled m6A水平和异构体特征化测序(4sU-m6A-LAICseq)及4sU-GLORI技术,以量化稳态和新合成RNA的m6A水平。揭示了许多转录本位点的m6A水平可能是转录后增强的,为当前关于共转录或转录后m6A修饰的争论提供了重要的见解。

文章索引
【标题】Nuclear retention coupled with sequential polyadenylation dictates post-transcriptional m6A modification in the nucleus
【发表期刊】Molecular Cell
【发表日期】2024年8月9日
【作者及团队】武汉大学生命科学学院周宇团队
【IF】15.58
研究结果
一. 4sU-m6A-LAIC-seq的开发
4sU-m6A-LAIC-seq是一种用于区分新合成RNA和稳态RNA中m6A水平的技术。
通过用4-硫尿苷标记新合成RNA,并使用IAA引发T-to-C转换,结合抗m6A抗体进行免疫沉淀,可以有效分离和量化m6A修饰的RNA。结果显示,这种方法能准确区分新合成RNA与稳态RNA,并有效量化其m6A水平。
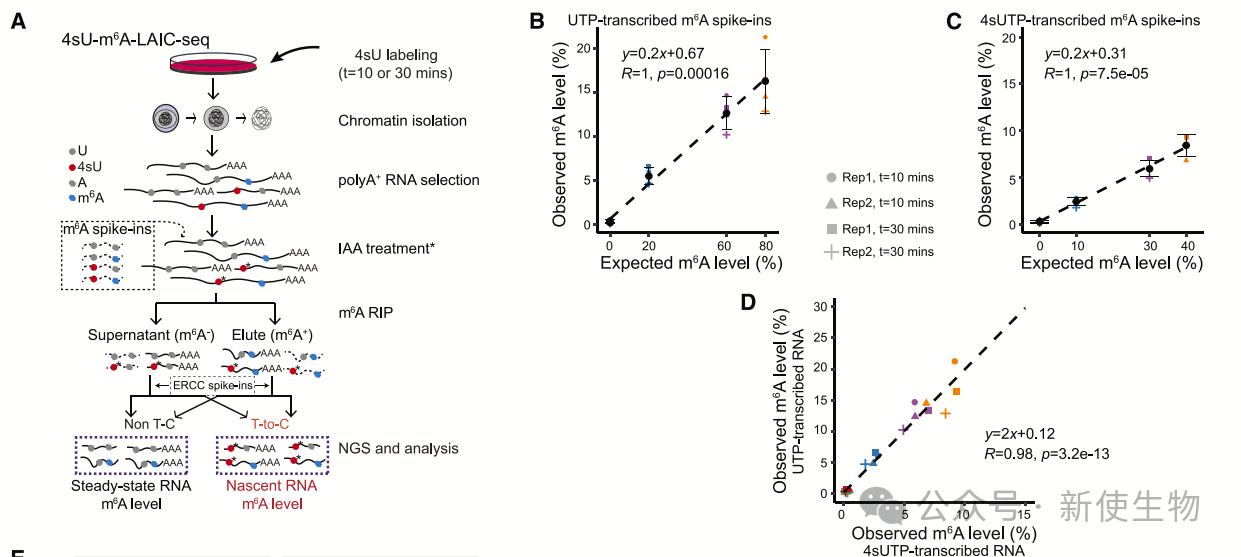
二. 4sU-GLORI的开发
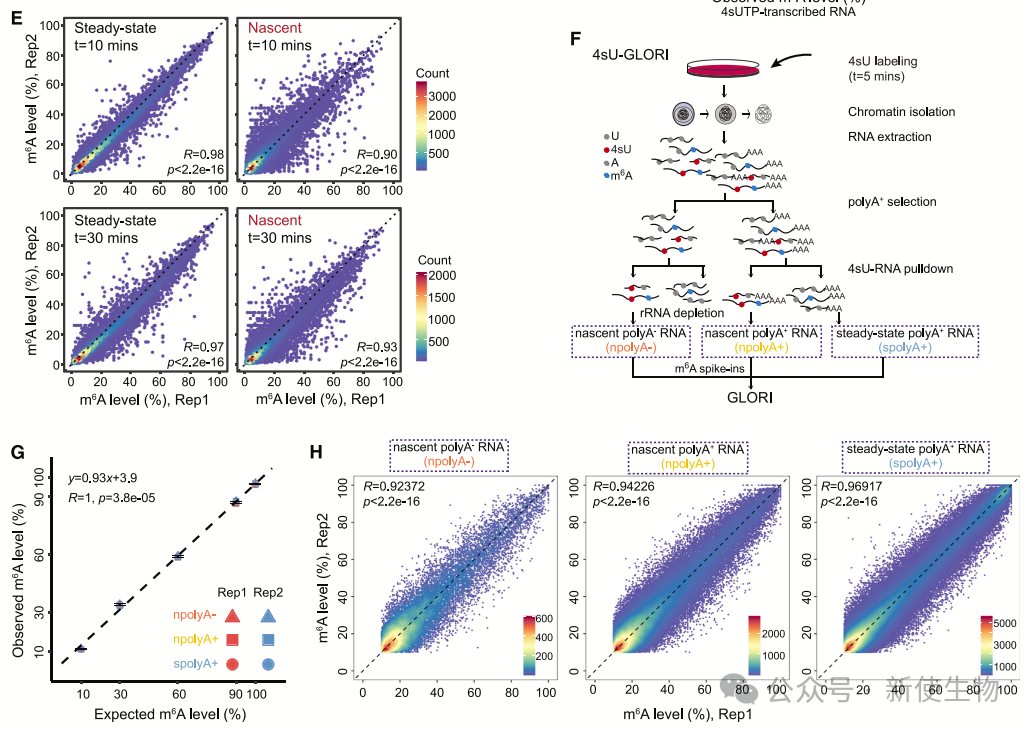
4sU-GLORI技术用于单核苷酸分辨率下量化新合成RNA和稳态RNA上的m6A水平。
该方法基于GLORI技术,通过4sU标记RNA、分离新合成和稳态RNA,并进行RNA测序和GLORI分析。结果显示,该技术能够准确测量m6A位点的绝对水平,验证了其在m6A水平量化中的有效性。
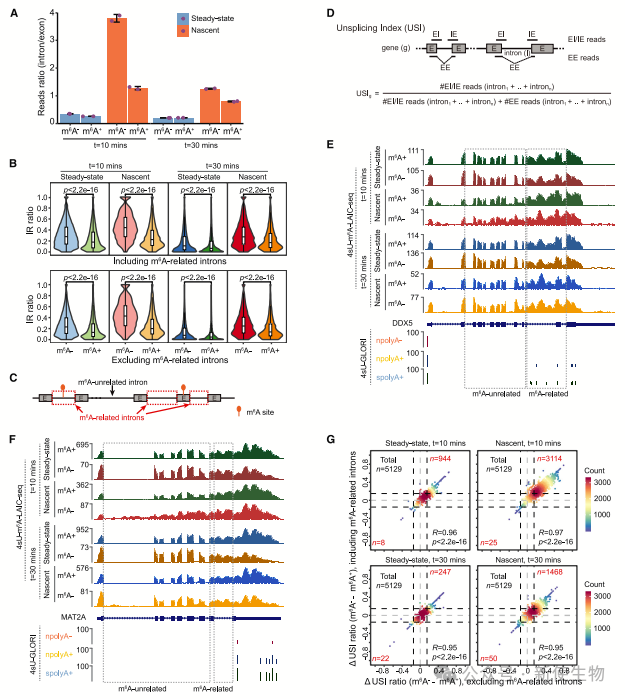
三. m6A阴性转录本的不完全剪接
m6A阴性转录本,尤其是10分钟标记的RNA,显示出更高的外显子-内含子或内含子-外显子接头比例,表明它们的剪接更不完全。
m6A阴性转录本的内含子保留比率较高,剪接不完整,尤其是在早期转录本中,这些结果暗示m6A可能主要在转录后而非转录过程中修饰RNA。
四. 广泛的转录后m6A修饰
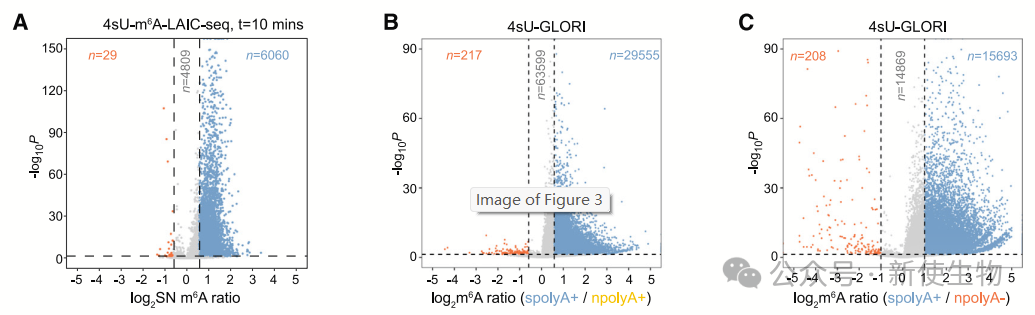
作者通过计算SN m6A比率(稳态RNA与新合成RNA的m6A水平比值)发现,大多数RNA在转录后经历了m6A修饰。
数据显示,55.6%的蛋白编码基因在10分钟的4sU标记下具有较高的SN m6A比率,而仅有少数基因表现相反。m6A阴性转录本的T-to-C转换比率显著高于m6A阳性转录本,表明新合成RNA的m6A修饰较少。
此外,4sU-GLORI数据表明,m6A修饰在转录后广泛发生,尤其是在spolyA+ RNA中,m6A水平普遍高于npolyA RNA。
五. 转录后m6A修饰的特点
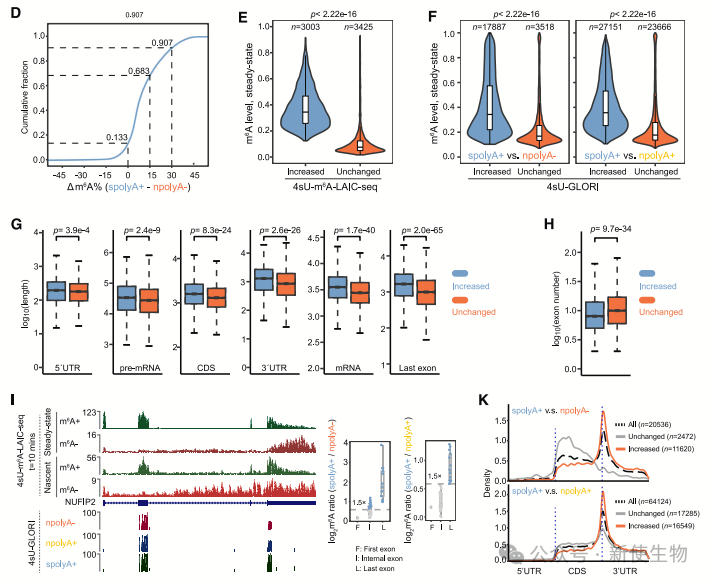
作者研究了转录后m6A修饰的特征,发现m6A增加的转录本在稳态RNA中的m6A水平较高,且具有较长的3' UTR和较少的外显子。
转录后m6A修饰主要发生在最后一个外显子,尤其是3' UTR部位,并且与位点的位置或确切序列无关。
分析显示,m6A高表达基因和m6A增加基因的富集相似,表明m6A水平高的转录本更容易经历转录后修饰。
六. 转录本中m6A水平较高的 RNA 在细胞核中的分布更加局限
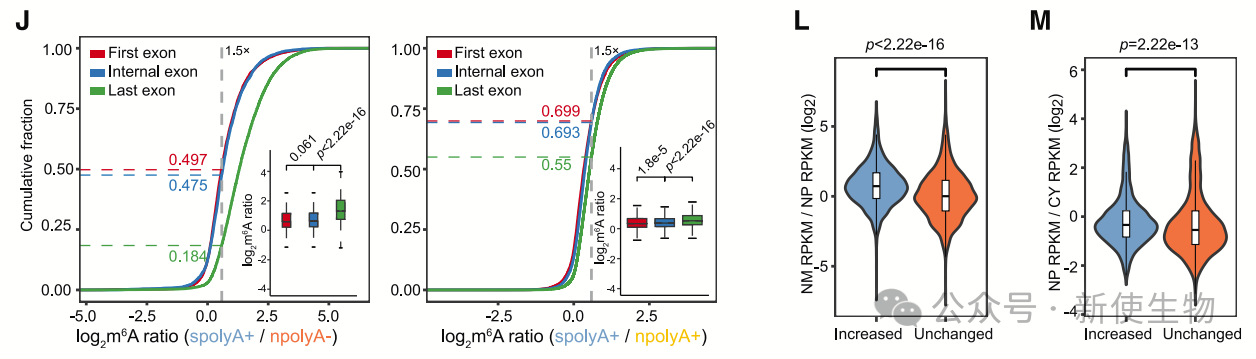
转录后m6A修饰与RNA在细胞核中的停留时间相关。m6A水平较高的转录本在核基质中的富集程度更高,表明这些转录本在转录后可能停留较长时间。
长间隔非编码RNA(lincRNA)和上游反义RNA(uaRNA)的m6A水平通常高于mRNA,且与YTHDC1的依赖性增加,说明m6A修饰和YTHDC1对RNA的高效核出口至关重要。
七. RNA在细胞核中的滞留促进了m6A修饰
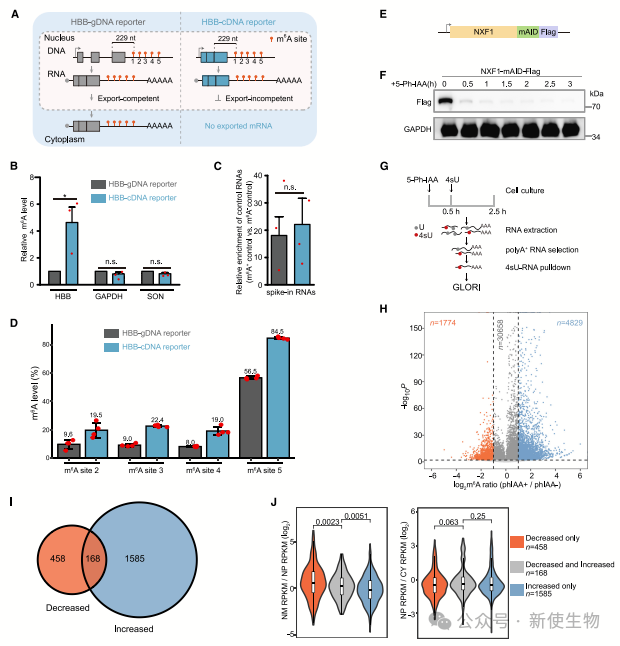
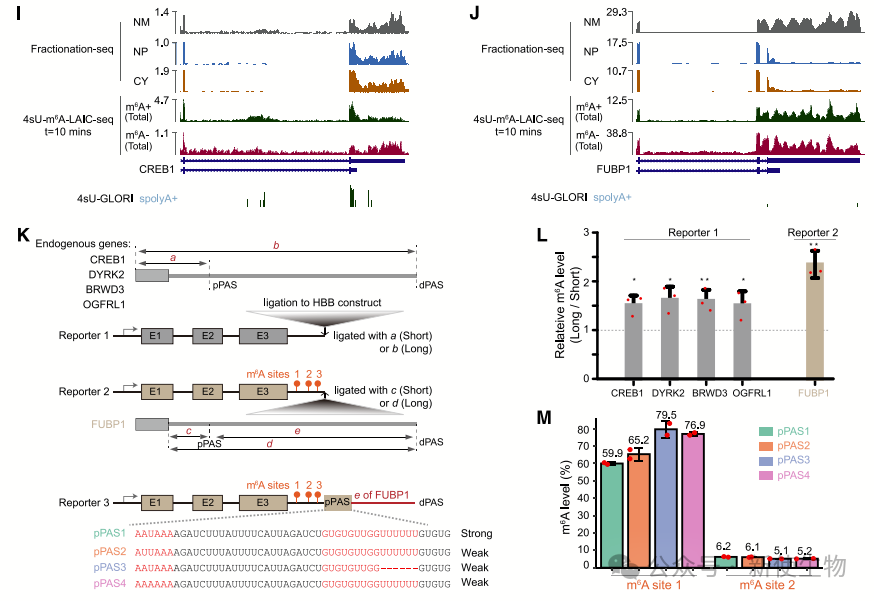
实验通过构建含有m6A位点的β-珠蛋白报告基因,发现无内含子的RNA其m6A水平显著高于有内含子的RNA。
此外,通过去除mRNA转运因子NXF1的实验也表明,RNA在核中的滞留时间越长,m6A修饰水平越高。这表明RNA核内滞留与m6A修饰的增强之间存在正相关关系。
八. m6A修饰对选择性聚腺苷酸化(APA)影响较小
作者发现一些基因的短3' UTR亚型比长亚型有更多的m6A修饰(如TRAF6),而其他基因则相反(如NANS)。
尽管m6A修饰与3' UTR的长度相关,但m6A对APA的影响有限。METTL3敲低后的APA模式变化较小,且APA因子与m6A修饰的关系不明显。
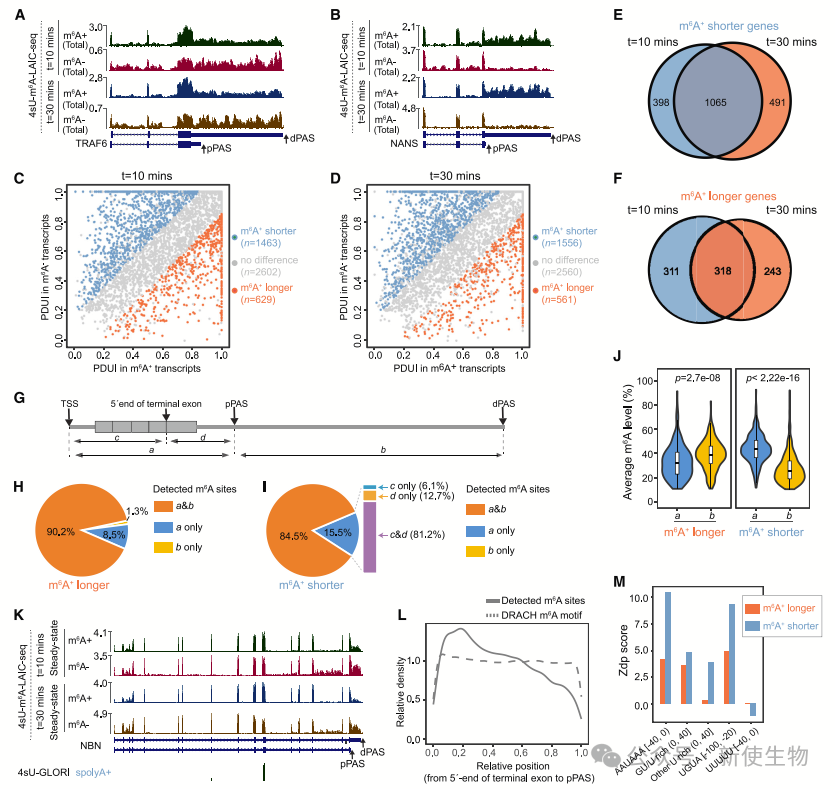
九. 顺序性多腺苷酸化生成m6A修饰的短3' UTR亚型
研究发现,m6A+短3' UTR亚型的pPAS使用频率低于长3' UTR亚型。dPAS与多腺苷酸化信号相关性更高,且dPAS通常先于pPAS使用。
在新合成RNA中,m6A修饰的短3' UTR亚型并未表现出明显的差异。顺序性多腺苷酸化过程中,dPAS使用较多,支持了m6A修饰的mRNA通过这种机制产生短3' UTR亚型。
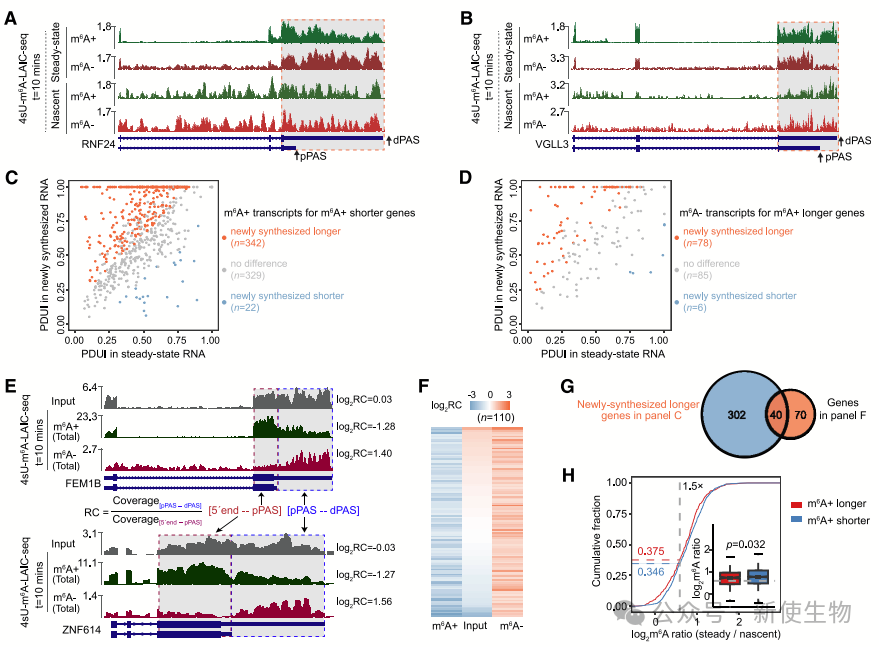
十. 顺序性多腺苷酸化促进m6A修饰
为了进一步证实顺序性多腺苷酸化对m6A修饰的作用,作者发现m6A+短3' UTR转录本的较长3' UTR异构体主要富集在核基质中。m6A+短基因的SN m6A比率普遍高于m6A+长基因。
通过实验,研究团队发现插入到HBB报告基因中的长3' UTR异构体的m6A水平通常比短3' UTR高1.5到2倍。
总结
m6A修饰通常被认为是在转录过程中加入的,但本研究发现,许多m6A修饰实际上发生在转录后,尤其是在m6A水平较高的转录本上。短3' UTR异构体上的m6A水平更高,这可能与顺序性多腺苷酸化和较长核内停留时间有关。因此,m6A修饰在转录后发生,并与其他RNA代谢过程密切耦合,动态调节表观转录组学。
新使n生物NeoRibo推出国内首款超高分辨率翻译组Ribo-seq建库试剂盒。
我们的Ribo-seq核糖体印迹分析技术(QEZ-seq®)适用于哺乳动物、植物、真菌等多类物种,无需复杂操作,建库只需2小时。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
简便快速的操作让翻译组分析不再设有门槛,每位科研学者都能轻松上手。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可联系杭州新使生物科技有限公司



 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们