新抗原介导的癌症免疫疗法(如T细胞疗法和疫苗)通过识别HLA呈递的抗原,激活CD8⁺细胞毒性T细胞以清除肿瘤。目前新表位多来源于癌症基因组中的非同义突变,但“冷”肿瘤突变少、表位稀缺,缺乏有效靶点。
近几年的研究发现,免疫原性表位也可来自非编码区的潜在翻译产物及非典型翻译,如UTRs、替代起始位点或非编码基因的翻译。这些非典型表位有望激活抗肿瘤免疫,且副作用更小,成为新型免疫治疗靶点。
传统蛋白质组学虽能识别肿瘤特异性肽段,但无法确定其是否被MHC呈递。免疫肽组学则通过质谱分析HLA结合肽段,提供更真实的表位图谱,尤其结合Ribo-seq核糖体印迹分析的反馈,能识别来自突变、异常表达、非典型翻译等来源的多种表位。
如在错配修复缺陷型结直肠癌和AML中的研究表明,非编码来源新抗原可诱导免疫反应。相比之下,RNA-seq仅反映转录水平,无法揭示实际翻译的开放阅读框或肽段降解情况,且抗原谱受多因素影响存在高度异质性。
因此,全面整合多种肿瘤与正常组织的翻译组和免疫肽组数据,对于发现和优选个体化癌症免疫靶点至关重要。

文章索引
【发表日期】2025年5月21日
【IF】14.95
研究结果
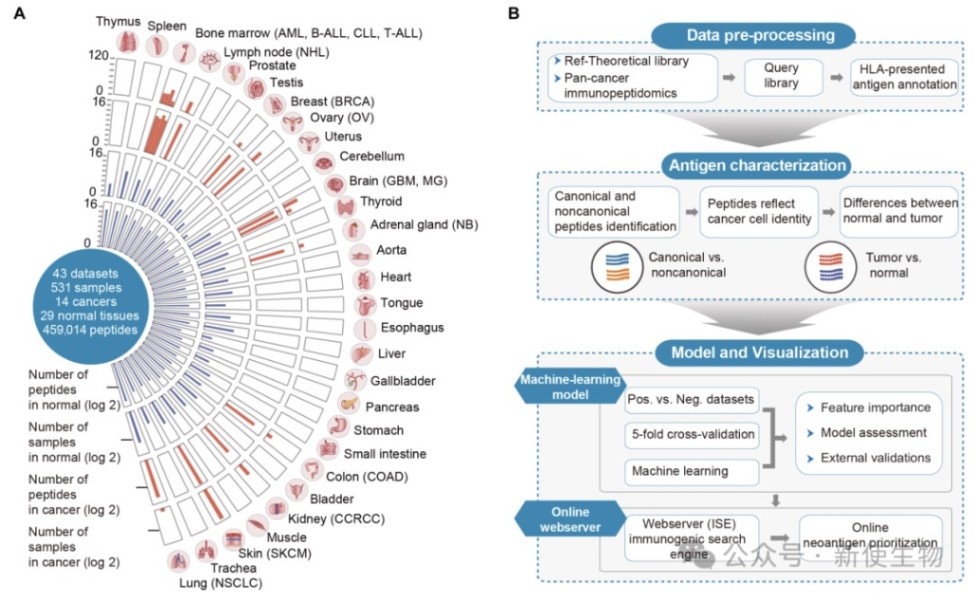
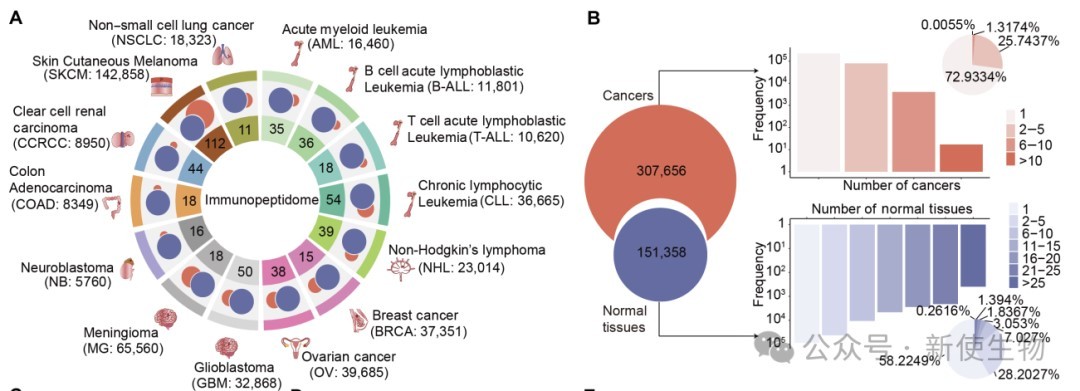
作者整合分析了531个样本的免疫肽组学数据和翻译组Ribo-seq数据,绘制出涵盖14种癌症和29种正常组织的肽段图谱,识别出约70000条非典型肽段,主要源自非编码区和移码翻译。
研究发现,许多低表达或未注释基因也能生成HLA呈递的肽段,说明免疫肽组学可揭示转录组RNA-seq难以捕捉的新抗原信息,为个体化癌症免疫治疗提供潜在靶点。
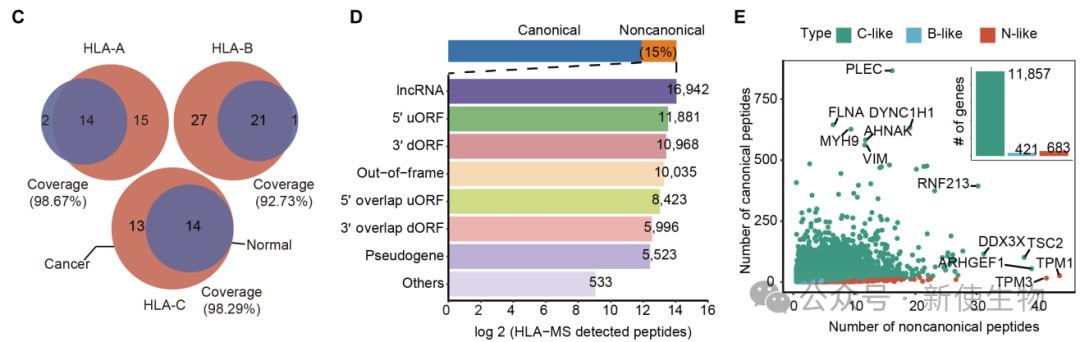
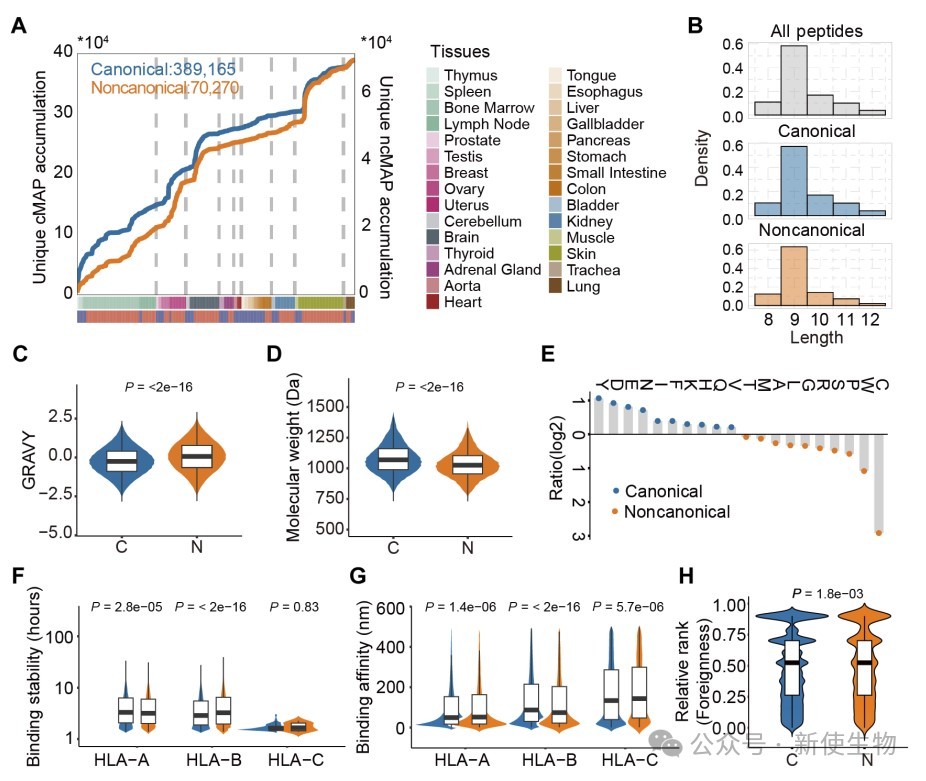
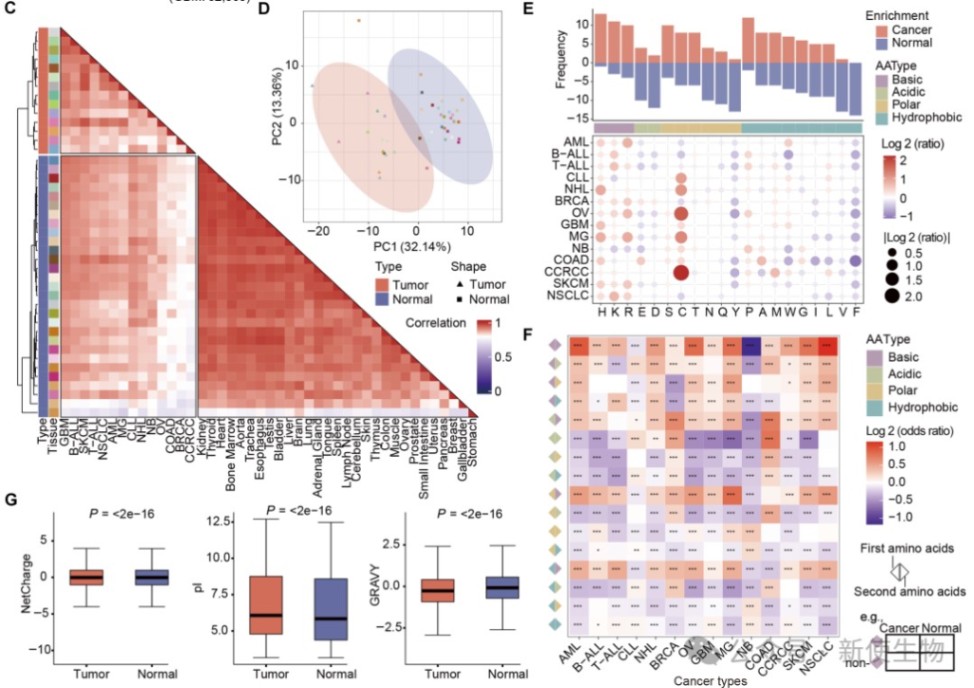
研究发现,HLA呈递的肽段在序列特征和理化性质上可明显区分肿瘤与正常组织,肿瘤肽段富含碱性和半胱氨酸残基,具有更高电荷和等电点,反映出其特有的微环境和代谢特征,提示HLA肽段可作为细胞身份的分子标识。
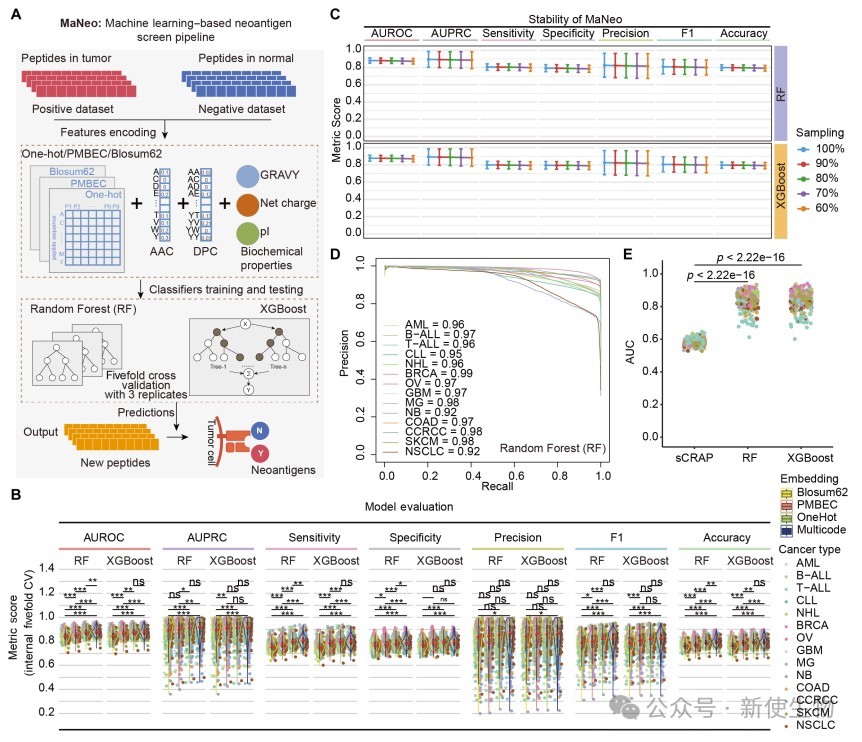
作者开发了基于机器学习的MaNeo流程,通过多种特征编码和分类器准确筛选肿瘤特异性新生抗原肽。
与sCRAP方法相比,MaNeo 在各项性能指标上均有显著提升,表明其结合序列和生化特征信息,能够高效、准确地预测多种癌症中的免疫原性新肽。
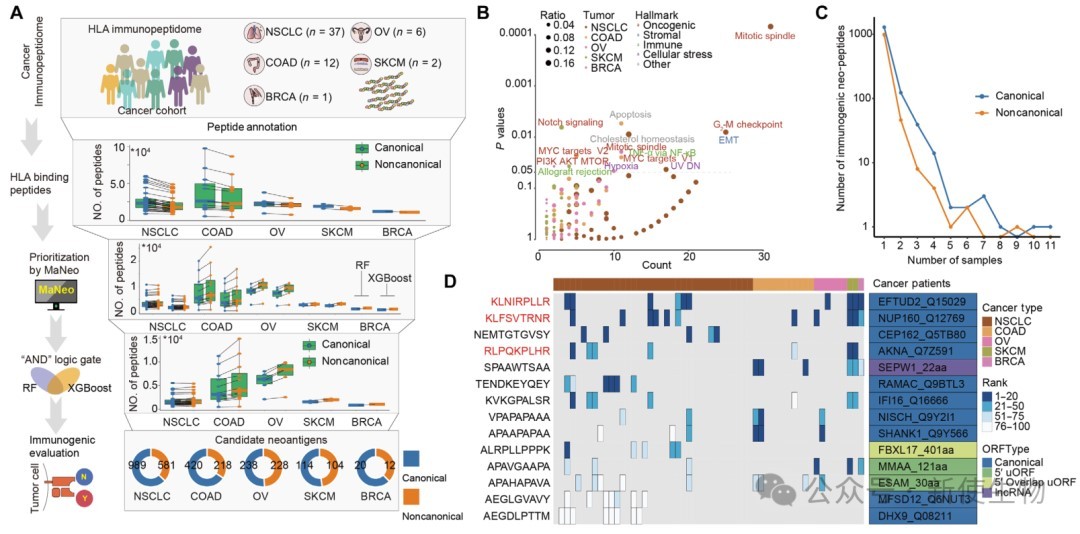
该模型成功筛选出2523个肿瘤特异性免疫原性新生肽,涉及多条癌症相关通路。部分新生肽在多例样本中复发,优选出3个功能验证候选。
蛋白水平显示这些新生肽对应蛋白在肿瘤细胞中高表达且肿瘤特异,验证了免疫组肽数据在新抗原识别中的关键作用。
候选新生肽载树突状细胞激活CD8+ T细胞,促进其增殖和细胞因子分泌,特异性识别肿瘤细胞且无损伤正常细胞,验证了其免疫活性和抗肿瘤效果,证明MaNeo模型预测准确且具泛化能力。

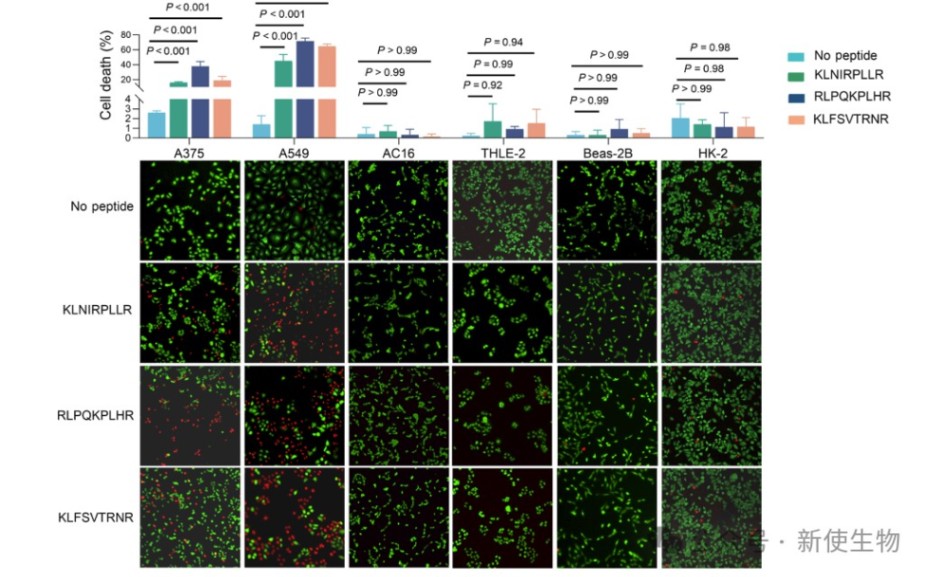
本研究构建了覆盖多种癌症和正常组织的泛癌肽图谱,发现非经典肽与经典肽呈现水平相当,且肿瘤特异性肽具有独特生化特征。基于此开发的机器学习筛选流程MaNeo,能精准识别肿瘤特异性新生肽,为新生抗原发现和癌症免疫治疗提供了有力工具。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们