急性髓性白血病(AML)是一种侵袭性血液系统恶性肿瘤,其五年死亡率高达70%。接受强化化疗的成人患者中约有一半会复发,而靶向治疗的疗效通常难以持久。
信号通路中常见的突变,如FLT3酪氨酸激酶和RAS,导致雷帕霉素靶蛋白复合物1(mTORC1)及丝裂原活化蛋白激酶(MAPK)信号失调,进而引发蛋白质合成增加、线粒体功能增强以及代谢适应性改变,从而促进白血病细胞的增殖与存活。
2025年5月22日,加拿大西格尔癌症中心François E.Mercier团队在Trends in Cell Biology上发表了一篇题为“Translational control of leukemic metabolism and disease progression”的综述文章,介绍了最近研究所揭示的真核起始因子4F(eIF4F)在调控白血病细胞代谢与存活相关蛋白表达中的关键作用,并探讨了其在AML中药理学干预该通路的潜在治疗价值。

综述整理
一. 急性髓性白血病的临床挑战与致癌特征
急性髓性白血病(AML)是一种侵袭性血癌,由造血干/祖细胞的遗传突变引发分化阻滞和白血病细胞增殖。常见症状源于正常造血功能受损,预后较差,成人五年生存率仅约30%。除罕见亚型外,长期缓解依赖于强化治疗和干细胞移植,复发率高。
AML具有高度基因异质性,靶向治疗疗效有限。白血病干细胞(LSCs)是复发和耐药的重要根源,成为关键治疗靶点。AML常伴信号通路突变(如FLT3、RAS),驱动mTOR、MAPK等活化,促进代谢重编程和细胞存活。
最新研究表明,这些通路通过调控mRNA翻译程序影响细胞命运,靶向翻译机制正成为有前景的治疗策略。
二. 致癌驱动因子对蛋白质合成的调控
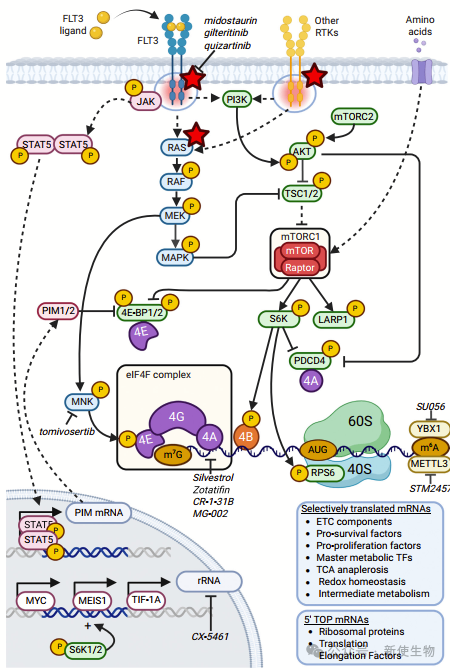
尽管存在异质性,AML的遗传驱动因素最终趋向于激活一系列直接或间接调控蛋白质合成的信号通路,主要包括PI3K/AKT/mTORC1、MAPK、STAT5以及 PIM1/2。
这些通路促进特定转录本的mRNA翻译,精细调控蛋白表达,以维持癌细胞的适应性和生存能力。
2.1)依赖帽结构的mRNA翻译起始是mTORC1信号通路的核心枢纽
mTORC1通过促进eIF4F复合物组装、激活S6K蛋白激酶及抑制负调控因子(如4E-BPs和PDCD4)来驱动依赖帽结构的mRNA翻译起始。这一过程选择性增强结构复杂、5′ UTR较长的癌相关mRNA的翻译,如细胞周期、代谢与凋亡调控基因。同时,mTORC1还通过促进rRNA合成与核糖体生物合成,增强整体蛋白质合成能力。
AML中的致癌突变(如FLT3、RAS、PIM1/2)通过激活PI3K/AKT/mTORC1、MAPK和STAT5通路,提升eIF4F复合物活性,推动白血病干细胞(LSCs)自我更新及AML进展。
此外,AML中的eIF4E普遍过表达,其敏感性mRNAs编码抗凋亡蛋白(如BCL2、MCL1)、细胞周期蛋白(Cyclin D、CDK4/6)及癌基因(MYC、PIM1),进一步促进肿瘤细胞存活和增殖。
三. 急性髓性白血病中mRNA翻译与代谢的关系
翻译与代谢是细胞的基本过程,互相依赖。蛋白质合成耗能大,需协调营养和氧气供应。AML中异常激活的PI3K/AKT/mTOR、MAPK和AMPK信号通路同时调控翻译和代谢。
白血病干细胞(LSCs)代谢独特,mRNA翻译是调控代谢的重要环节,也是潜在治疗靶点,针对翻译过程有望突破直接靶向代谢蛋白的难题。

3.1)氧化磷酸化 (OX/PHOS)
AML细胞线粒体较少但体积大,活性增强且通过转录后调控调节能量代谢。化疗促进氧化磷酸化基因表达,预后较差。
BCL2抑制剂Venetoclax能有效破坏AML干细胞线粒体功能。部分线粒体抑制剂在临床前有效,但临床效果有限且有毒副作用。
3.2)氧化还原稳态
NADH/NAD⁺失衡导致AML细胞产生ROS,AML通过NAMPT合成NAD⁺和SLC25A51转运补偿。干扰SLC25A51增加ROS,抑制AML生长。
SIRT5调控代谢促进AML发展,抑制SIRT5延缓病情。LSCs依赖ROS清除,阻断谷胱甘肽合成破坏线粒体,减少LSCs。
3.3)氨基酸和脂肪酸的补充代谢
AML中,LSC对谷氨酰胺依赖性不同,抑制相关酶可阻止癌细胞生长。耐药LSC通过增强脂肪酸摄取和氧化替代氨基酸代谢,维持能量和抗氧化能力。
骨髓微环境通过物质供应和线粒体转移支持白血病代谢和耐药,骨髓基质细胞的翻译调控作用仍待研究。
3.4)AML代谢中致癌驱动因素的影响
致癌基因FLT3ITD通过mTORC1/ATF4促进AML细胞丝氨酸合成和耐药,同时增强线粒体OX/PHOS代谢。RAS突变促进脂肪酸氧化,抑制氨基酸代谢,影响治疗反应。谷氨酰胺和谷胱甘肽代谢对多种AML驱动基因相关的耐药性有重要作用。其他驱动基因的代谢调控机制尚未明确。
3.5)AML中与代谢适应相关的翻译调控
AML中代谢的翻译调控研究有限,但已有证据表明帽依赖性翻译通过调节线粒体功能和抗凋亡蛋白维持代谢稳态。
mTORC1通路及RNA结合蛋白调控关键代谢相关蛋白的翻译,影响AML细胞的代谢重编程和药物耐受。深入了解这些机制有助于开发新型治疗策略。
四. AML中靶向翻译的治疗机会
4.1)AML中靶向上游PI3K/AKT/mTORC1信号通路
mTORC1通路在AML中促进病情发展和耐药,但临床抑制效果有限,主要因反馈激活PI3K/AKT信号和翻译调控因子异常。FLT3突变AML中,耐药机制涉及翻译调控,导致蛋白合成持续活跃。
因传统抑制剂难以完全阻断蛋白质合成,研究重点转向直接靶向翻译机制的新疗法。
4.2)靶向AML中的帽依赖性翻译起始
AML中抑制eIF4F及其调控因子(如MNK1/2)可诱导白血病细胞死亡,抑制肿瘤生长。
多种eIF4A抑制剂(rocaglates类)在实验中显示良好抗AML活性,作用机制包括抑制线粒体代谢和促凋亡。目前部分药物已进入临床试验阶段。
4.3)AML中核糖体生物合成的靶向治疗
干扰AML核糖体生物合成可抑制LSC自我更新和代谢重编程。CX-5461抑制rRNA合成,有抗白血病作用但临床进展有限。抑制eIF4A3阻断细胞周期基因翻译,选择性杀死AML细胞,rocaglates类药物可能通过此机制发挥抗癌效应。
4.4)AML中翻译延伸的靶向治疗
通过药物或基因干扰调控白血病驱动基因mRNA翻译效率,可以促进髓系分化并抑制肿瘤生长。
关键靶点包括催化m6A修饰的METTL3和参与m6A mRNA多聚核糖体招募的YBX1。METTL3抑制剂STM2457能降低致癌转录因子mRNA的m6A水平,导致核糖体阻滞和蛋白表达下降,抑制AML发展。YBX1基因抑制则减弱包括MYC、BCL2和MCL1等致癌转录本的翻译,降低AML细胞增殖和克隆能力。
总结
AML中上游致癌通路调控mRNA翻译,影响病情进展和代谢重编程。研究目前尚少,技术挑战大,尤其是单细胞水平的翻译和代谢分析。未来需解决最佳模型选择、适合治疗的AML亚型、疗效预测标志物以及翻译抑制的安全性等问题,以推动靶向翻译的新疗法开发。
新使生物NeoRibo推出国内首个低起始量超高分辨率翻译组Ribo-seq服务。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们