多数病毒通过抑制宿主蛋白质合成(shutoff)来削弱免疫反应,并优先利用核糖体翻译病毒mRNA。除调控mRNA生成与稳定外,病毒也可通过干扰宿主翻译起始机制实现选择性关闭。大多数宿主mRNA依赖帽结构及多个起始因子(如eIF4F、eIF3)进行翻译,eIF3可同时结合40S核糖体、mRNA及eIF4F。
RNA病毒常破坏eIF4F并通过IRES元件绕过其依赖维持自身翻译,而大多数DNA病毒在细胞核中复制并产生带帽mRNA,主要通过抑制宿主mRNA生成诱导shutoff。
痘苗病毒(VacV)是可在胞质内复制的DNA病毒,拥有自主的转录和加帽机制,其早期mRNA与宿主mRNA共同翻译。感染后期,VacV通过去帽酶降解宿主mRNA,并依赖5′ polyA-前导序列与核糖体蛋白修饰,采用帽非依赖的翻译起始方式。
尽管整体翻译关闭,部分宿主mRNA(如编码线粒体蛋白的)仍可逃逸并继续翻译。VacV感染下,线粒体mRNA表达下降但翻译效率升高,表明翻译调控可能影响蛋白表达谱。但在9000种蛋白中,仅约70种显著上调,具体机制尚不清楚。

文章索引
【发表日期】2025年5月28日
【IF】30.96
研究结果
先前VacV感染的核糖体研究多集中于早期(2–8小时),而翻译抑制在16–24小时更明显。
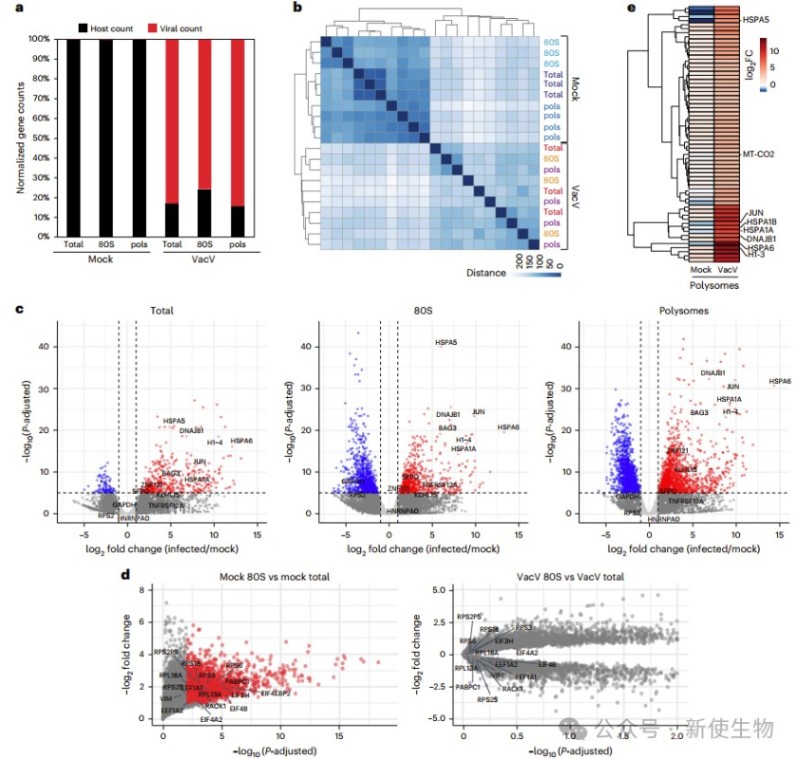
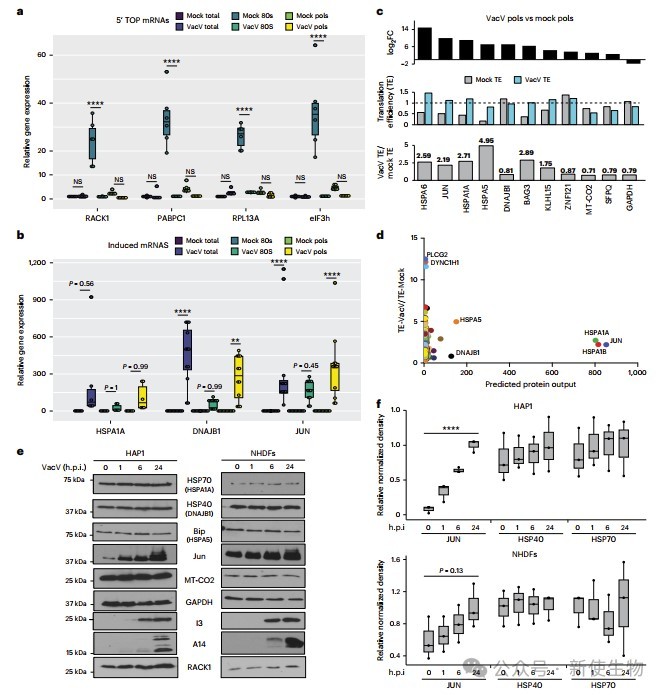
作者在24小时对HAP1细胞进行Polysome profiling多聚核糖体分析,发现感染样本中大部分RNA为病毒mRNA。未感染细胞的80S核糖体富集的TOP结构宿主mRNA在感染后显著减少,而部分如JUN和HSPA6的mRNA在转录和翻译水平均上升。
PCR验证显示GAPDH表达下降,JUN和热休克蛋白mRNA上升。尽管一些mRNA翻译效率预测升高,但因总量下降,蛋白产出未必增加。JUN蛋白显著增加,HSP40和线粒体蛋白变化有限,该现象在多种细胞类型及另一痘病毒感染中均有类似表现。
综合分析表明,JUN是VacV感染中转录和翻译双重上调的关键宿主基因。
二. JUN与病毒5′非翻译区采用不同的起始机制
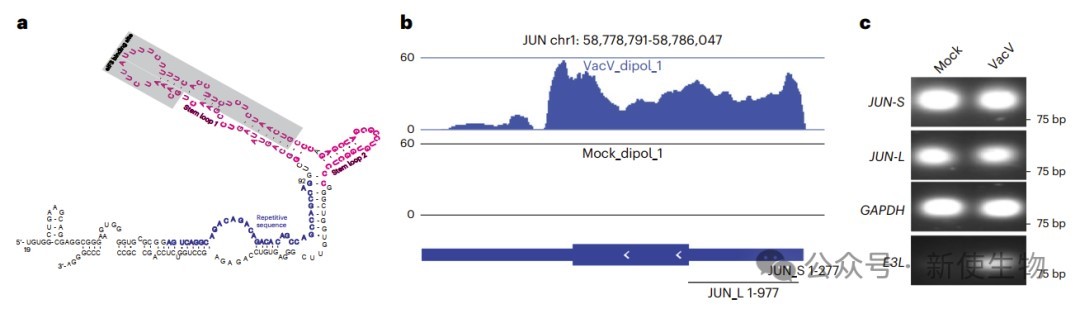
JUN基因的5′ UTR高度有结构性,含有与eIF3亚基eIF3d结合的茎环区,支持一种替代的帽依赖起始方式。
作者利用SV40启动子的报告基因检测,发现感染促进了JUN-S(茎环区)和JUN-L(全长)报告基因表达,但只有JUN-L的激活出现在感染晚期,且自然存在于感染细胞中。
当敲低eIF3d或eIF3a后他们发现,JUN蛋白表达不受影响,而晚期病毒蛋白依赖eIF3a和RACK1。RACK1缺失不影响JUN表达,反而使其基础水平升高,但减少病毒蛋白。不同5′ UTR的报告基因活性与原生蛋白表达一致,表明5′ UTR决定了病毒和JUN mRNA在感染期间不同的翻译启动策略。
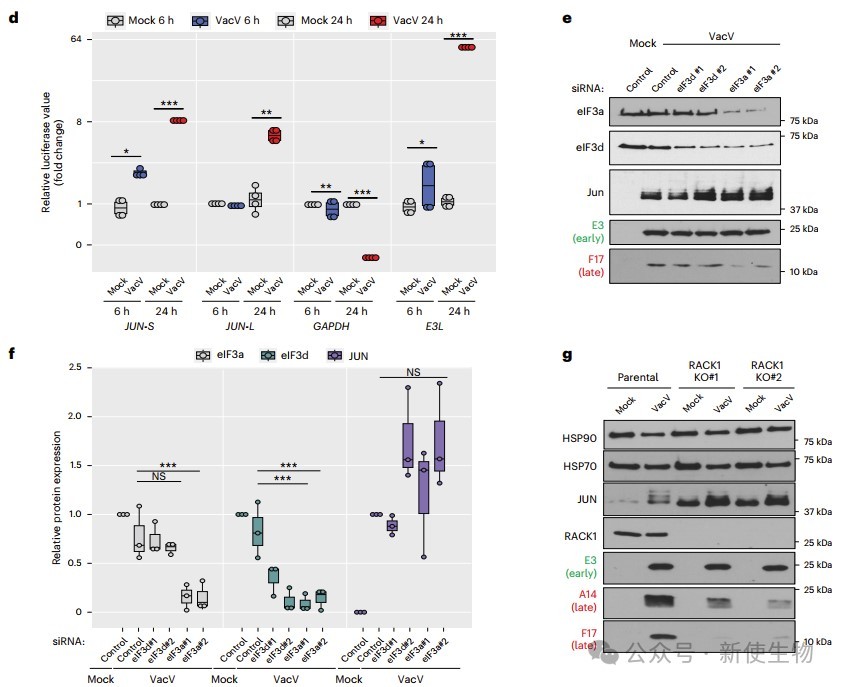
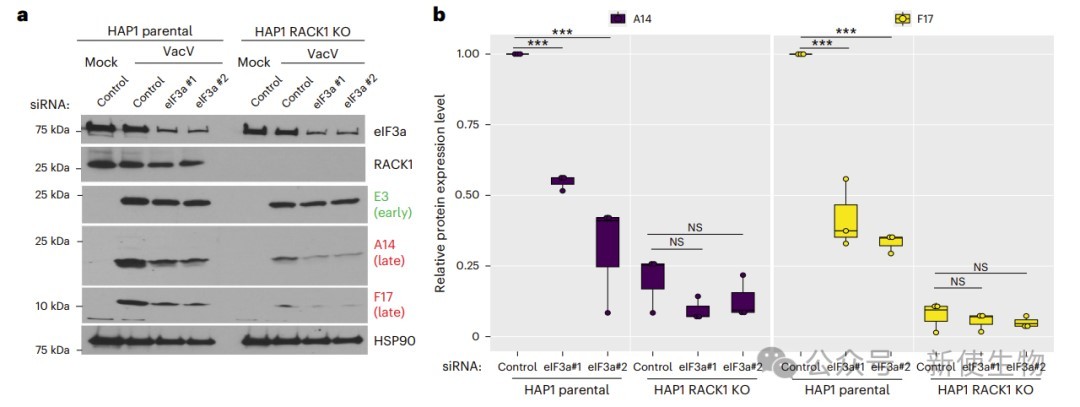
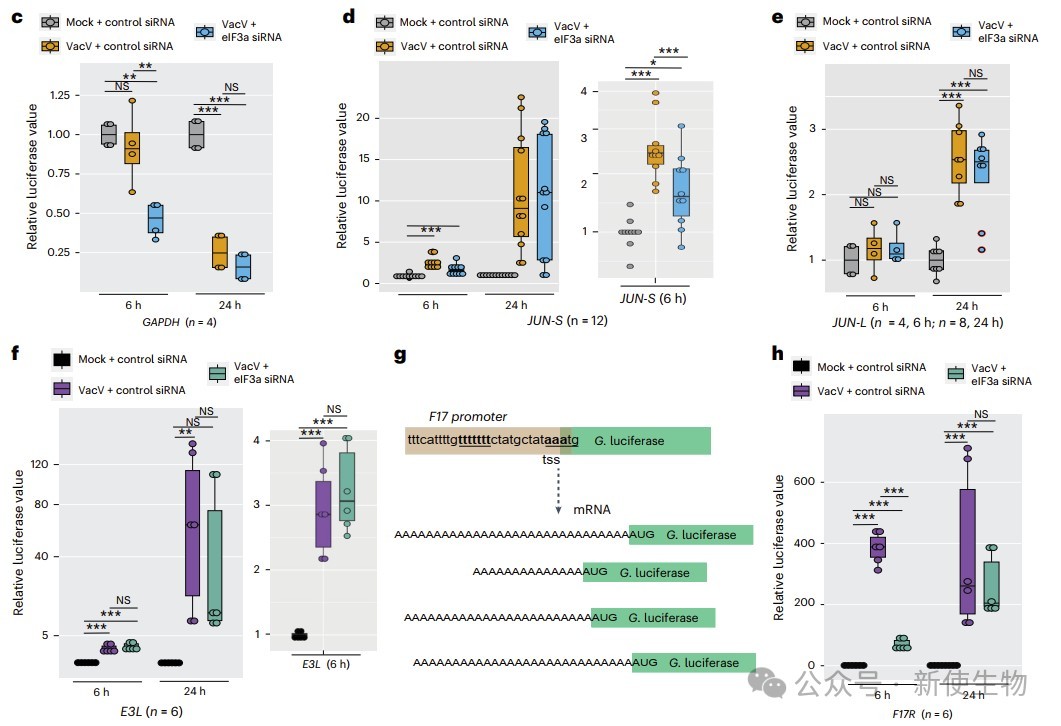
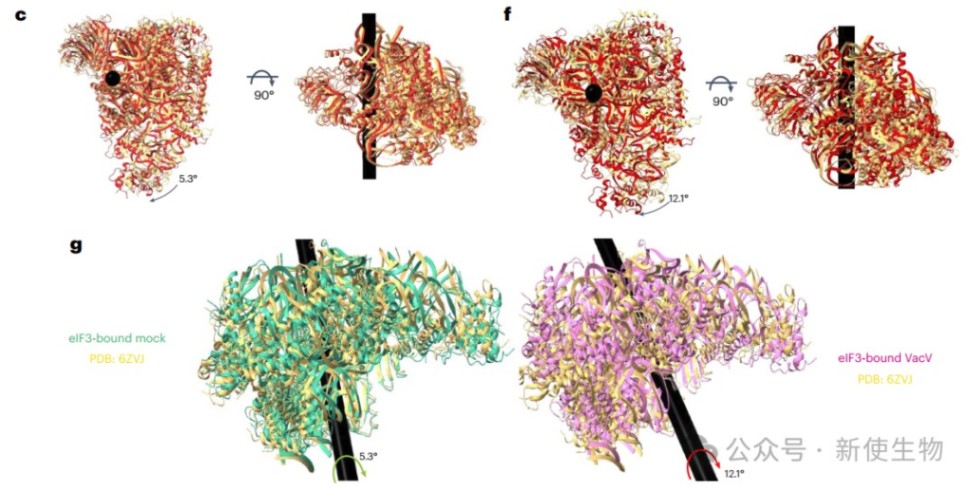
三. eIF3与病毒修饰的40S核糖体有关
VacV修饰的RACK1磷酸模拟体改变了40S核糖体头部的摆动运动,并支持非经典的翻译起始。然而,感染过程中是否发生类似变化尚不清楚。
研究团队通过冷冻电镜分析了来自假感染和VacV感染细胞中带Flag标签的RACK1结合的40S核糖体结构,发现感染组中eIF3结合的40S头部摆动幅度明显增大,且运动方向不同,表明痘病毒感染改变了eIF3对40S头部运动的调控。
这种构象灵活性的增强,可能促进病毒mRNA的非经典eIF3依赖起始,而JUN的5′ UTR则在此条件下对eIF3的依赖减少。
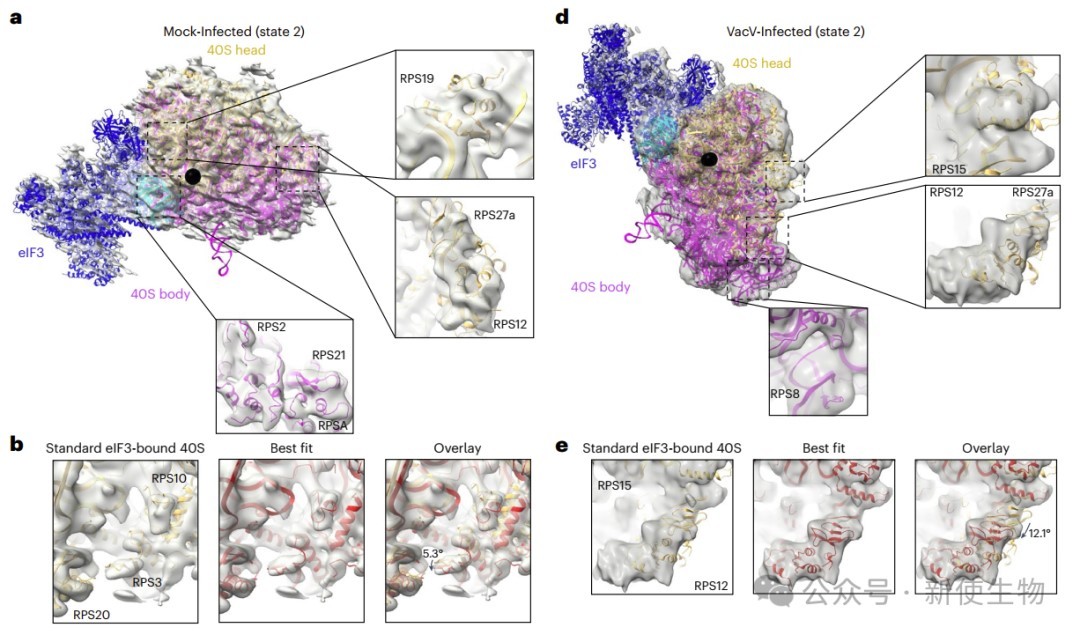
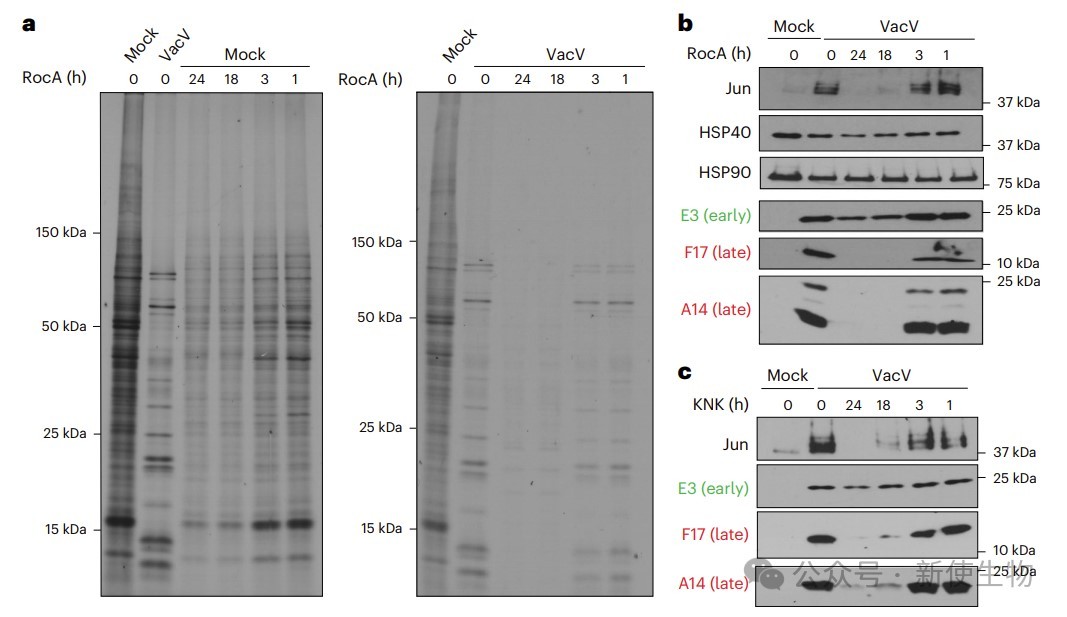
四. JUN依赖eIF4A且促进病毒扩散
作者用Rocaglamide A (RocA) 抑制eIF4A,发现其能抑制JUN及病毒蛋白的翻译,显著降低病毒蛋白合成和积累。RocA处理还降低了Jun和某些热休克蛋白(HSP)的表达。
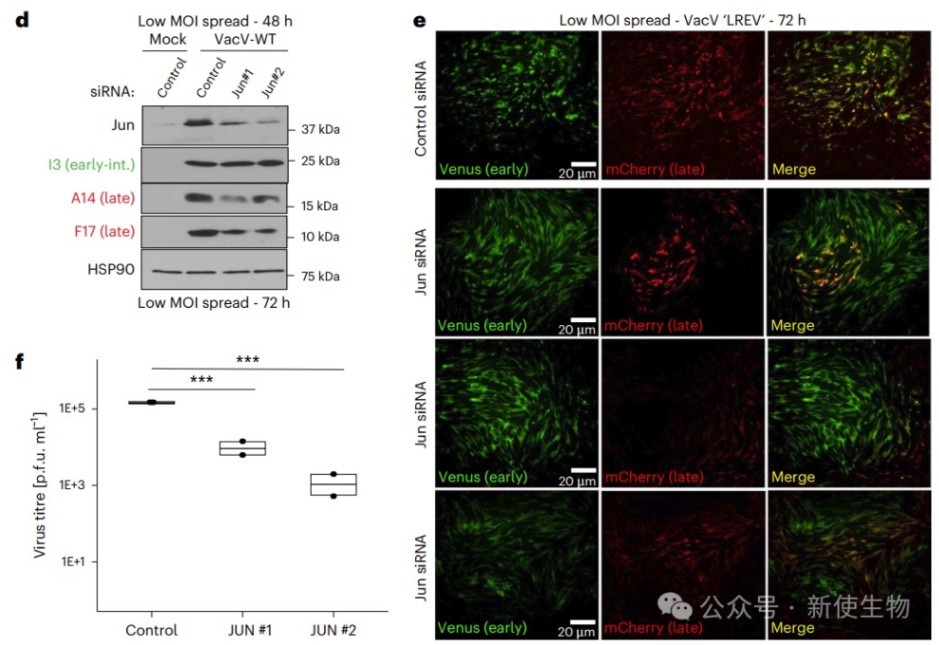
HSF-1抑制剂KNK437同样抑制了Jun诱导和病毒晚期蛋白的表达。敲低JUN不影响病毒高MOI条件下的复制,但显著抑制了低MOI多轮感染中的病毒扩散,表明JUN及部分热休克蛋白参与促进病毒传播。
总结
本研究发现病毒抑制宿主蛋白合成,但部分宿主mRNA(主要是JUN)仍被翻译。病毒mRNA翻译依赖RACK1和eIF3,JUN翻译则依赖较少。冷冻电镜显示感染使结合eIF3的40S核糖体结构发生变化,揭示病毒和宿主蛋白在宿主关停期采用不同翻译机制。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们