N6-甲基腺苷(m6A)是一种可逆的RNA表观遗传修饰,由METTL3/14、WTAP等甲基转移酶和FTO、ALKBH5等去甲基酶调控,参与多种生理与病理过程。
m6A识别蛋白如YTHDF1-3可调控RNA的加工、翻译与降解,YTHDF1促进翻译,YTHDF2介导降解,YTHDF3则协调两者功能。
不过,YTHDF2在某些情况下,如胶质母细胞瘤和乙肝相关肝癌中,反而稳定m6A修饰RNA,并在热休克中参与翻译调控,提示其功能复杂且依赖具体环境,其非降解相关机制尚不清楚。
卵巢癌是最致命的妇科癌症,女性癌症死亡的第五大原因。由于缺乏有效治疗,晚期卵巢癌5年生存率仅约30%。标准治疗虽包括手术和含紫杉醇的化疗,但普遍存在耐药问题,亟需新靶点以改善疗效并克服耐药。

文章索引
【发表日期】2025年6月5日
【IF】15.58
研究结果
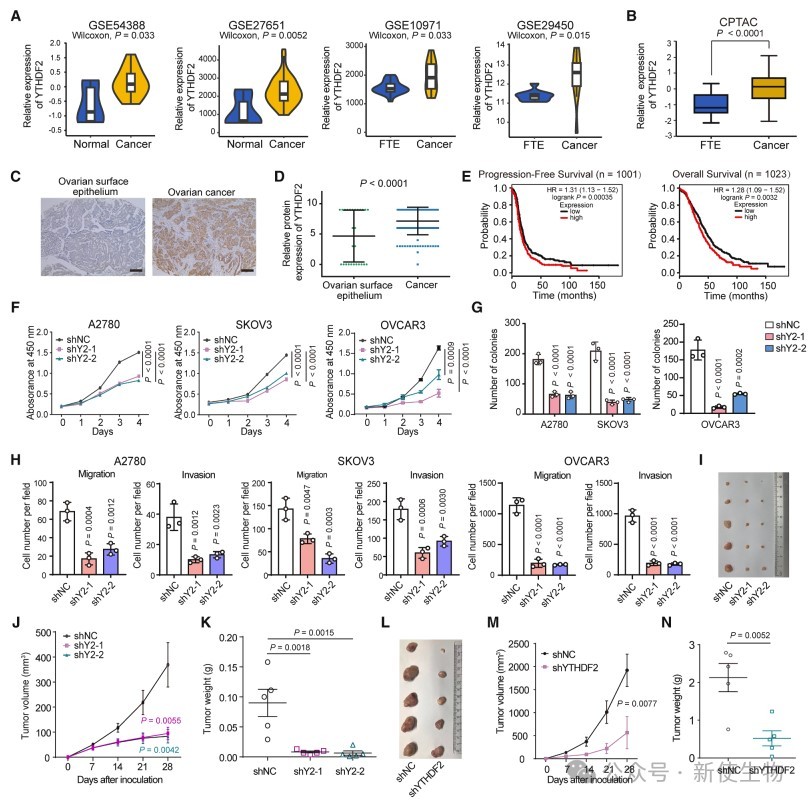
一. YTHDF2在卵巢癌中的临床与功能重要性
作者通过全基因组CRISPR-Cas9筛选,发现YTHDF2在卵巢癌细胞中高表达。数据库和患者样本均显示YTHDF2与肿瘤分级和分期正相关,高表达预示预后较差。
抑制YTHDF2能显著抑制卵巢癌细胞的增殖、迁移和侵袭,并减缓裸鼠体内肿瘤生长和转移,表明YTHDF2促进卵巢癌进展。
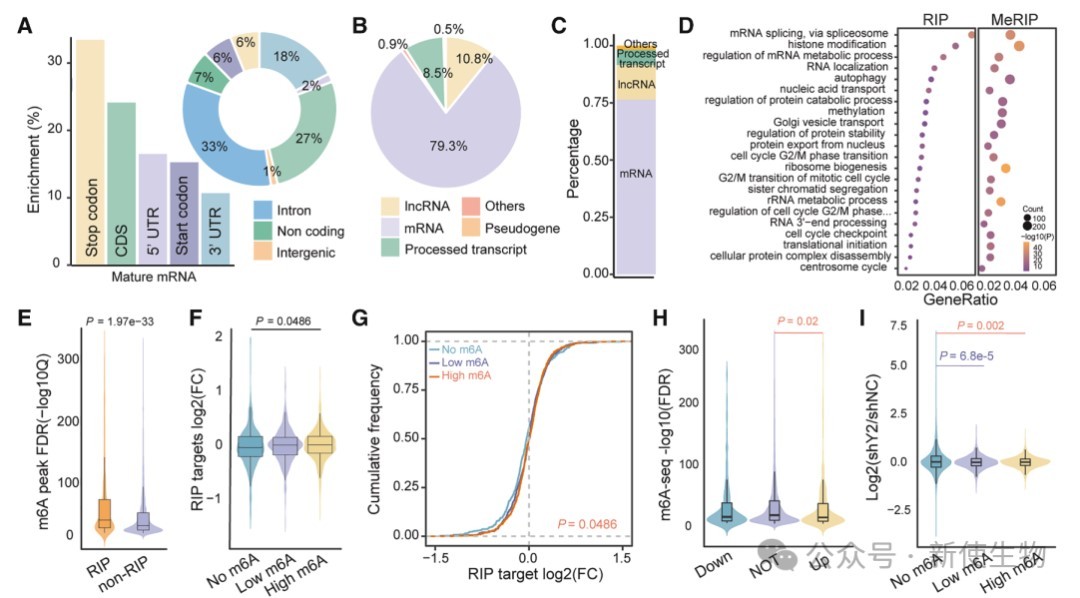
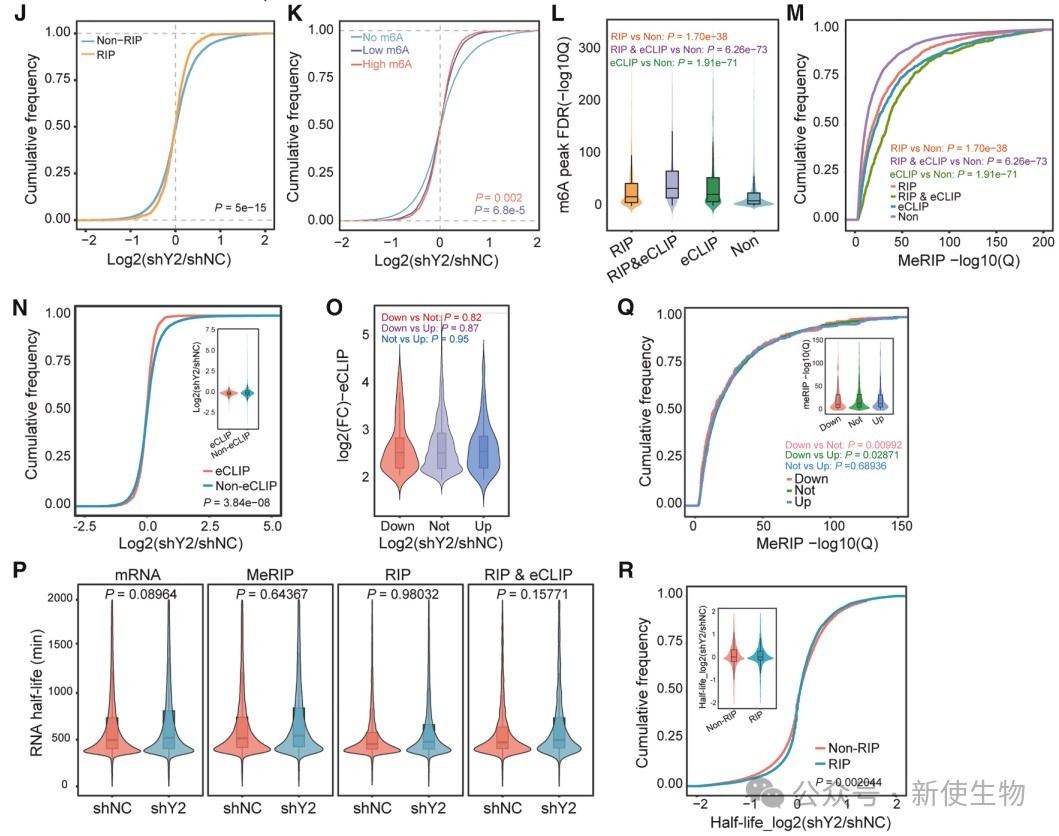
二. YTHDF2结合m6A修饰mRNA但对其丰度影响较小
团队通过多组学分析发现,尽管YTHDF2可以结合大量m6A修饰的mRNA,但其敲除对这些转录本的丰度和稳定性影响甚微,提示YTHDF2在卵巢癌中主要承担识别功能,而非调控mRNA降解。
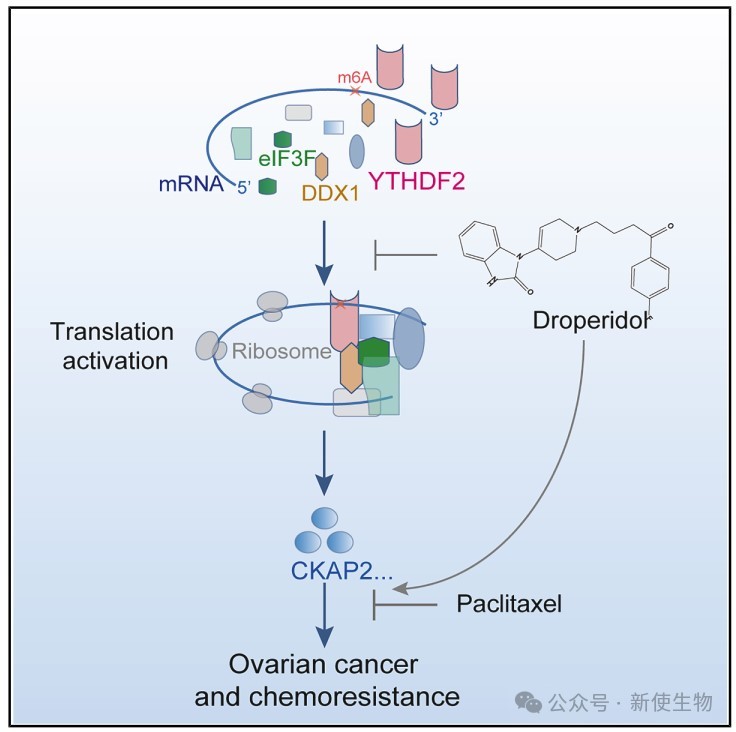
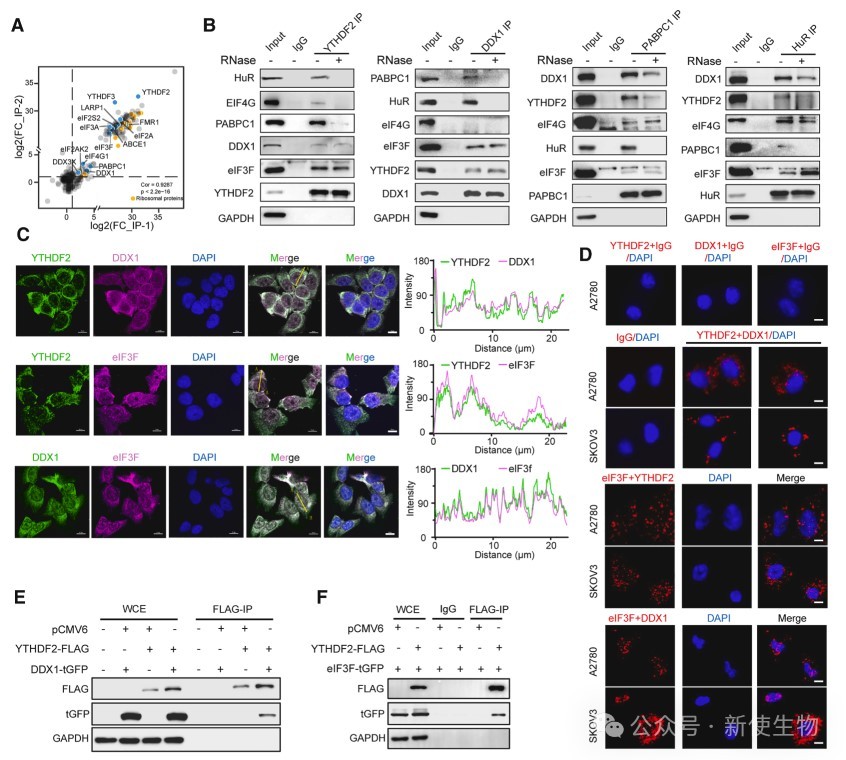
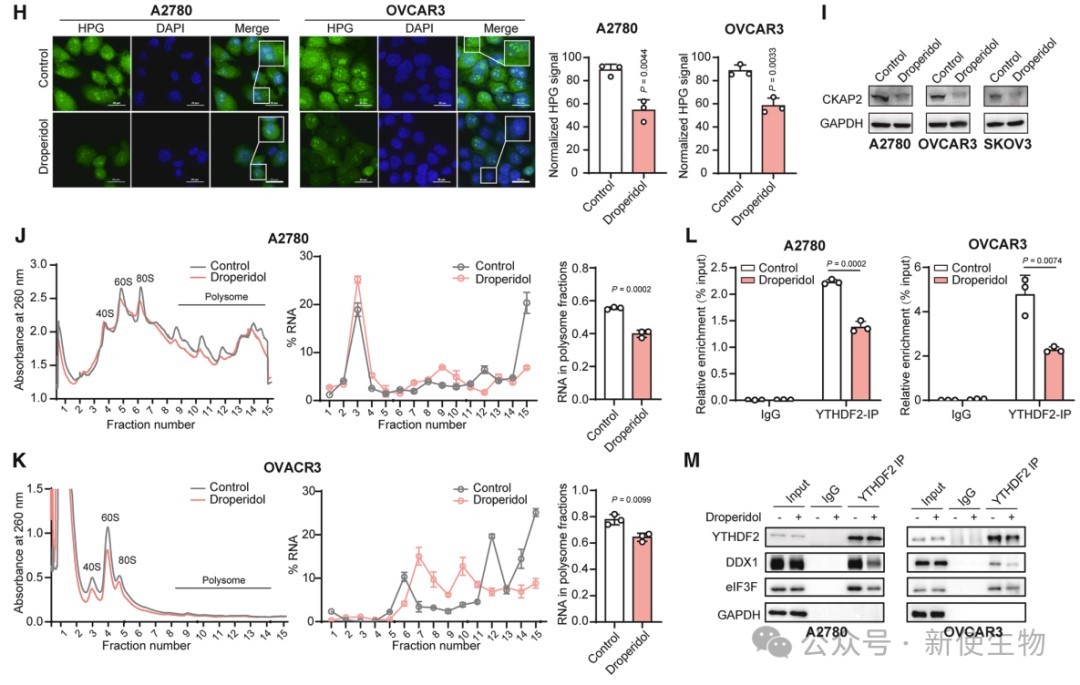
三. YTHDF2可与DDX1和eIF3F直接相互作用
研究发现,YTHDF2通过其C端结构域与DDX1和eIF3F直接结合,该结合不依赖于m6A识别功能。
YTHDF2与DDX1共同参与翻译起始复合物的调控,影响卵巢癌细胞的蛋白质合成过程。
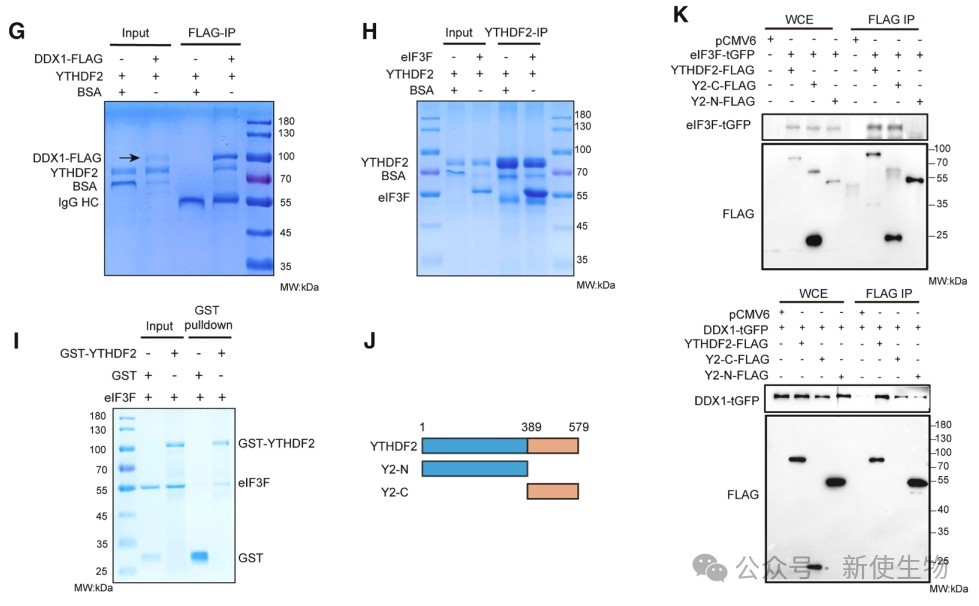
四. YTHDF2与DDX1促进蛋白质合成
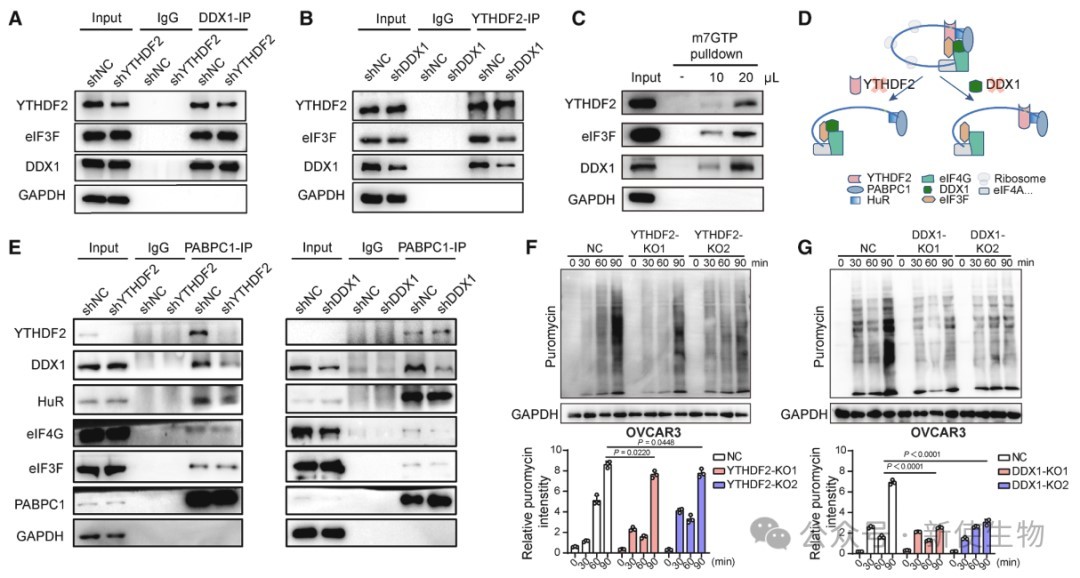
DDX1与eIF3F形成复合物,YTHDF2增强其结合。YTHDF2和DDX1通过RNA依赖性与PABPC1和eIF4G相互作用,参与mRNA翻译复合物。
敲低YTHDF2或DDX1均抑制蛋白质合成,恢复表达可部分逆转,表明两者协同促进卵巢癌细胞蛋白质合成。
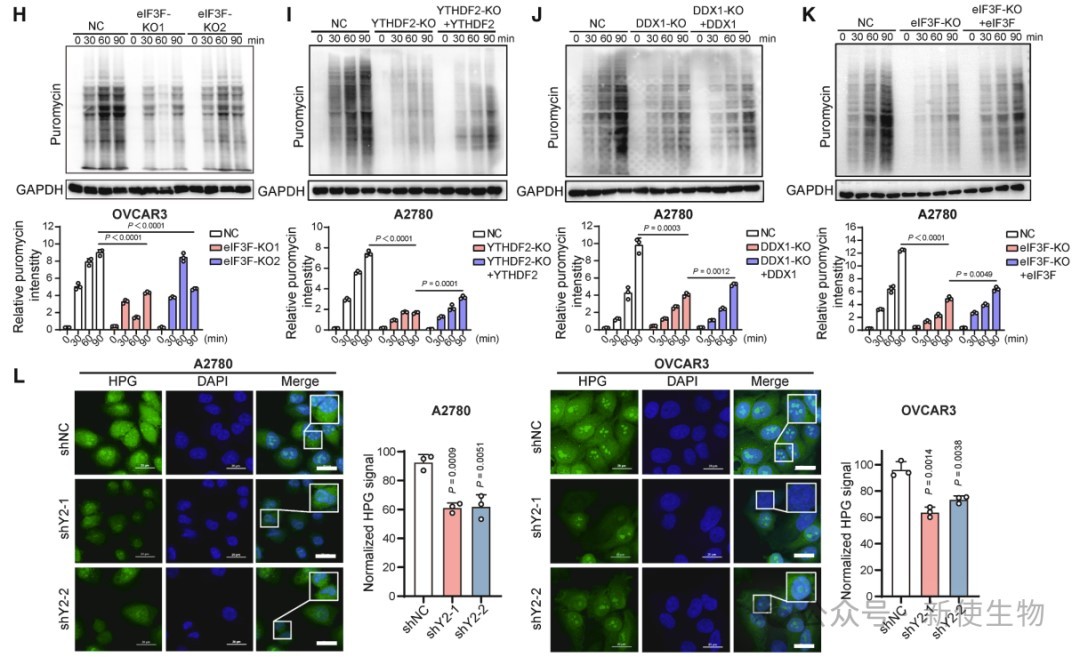
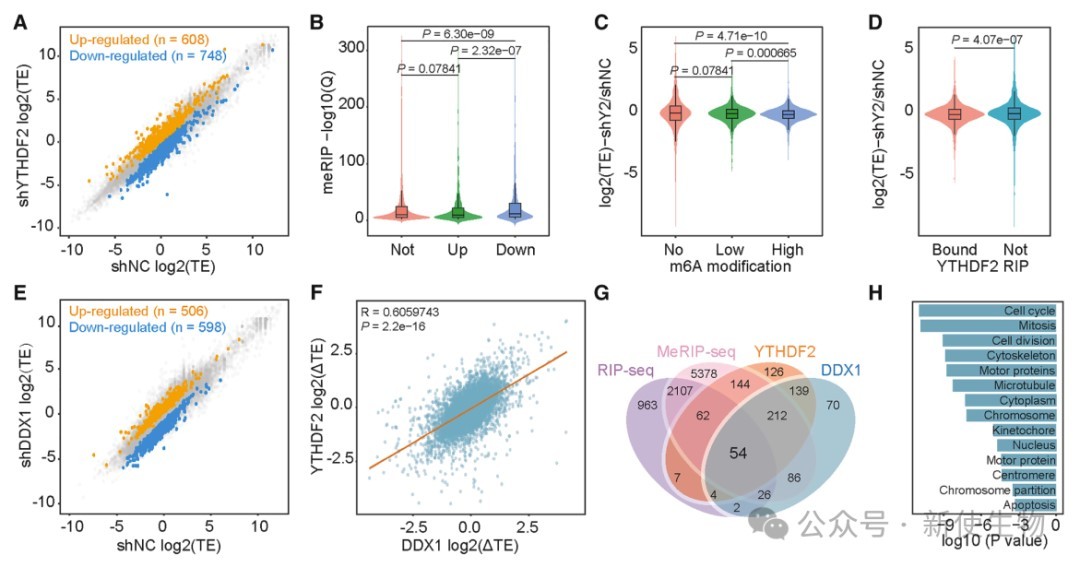
五. YTHDF2和DDX1促进微管蛋白的翻译
作者通过Ribo-seq核糖体印迹分析发现,YTHDF2和DDX1促进m6A修饰基因的翻译,尤其是与微管和细胞周期相关的基因,其缺失导致这些基因的蛋白质表达下降但mRNA水平无显著变化,表明二者协同调控关键靶基因的翻译。
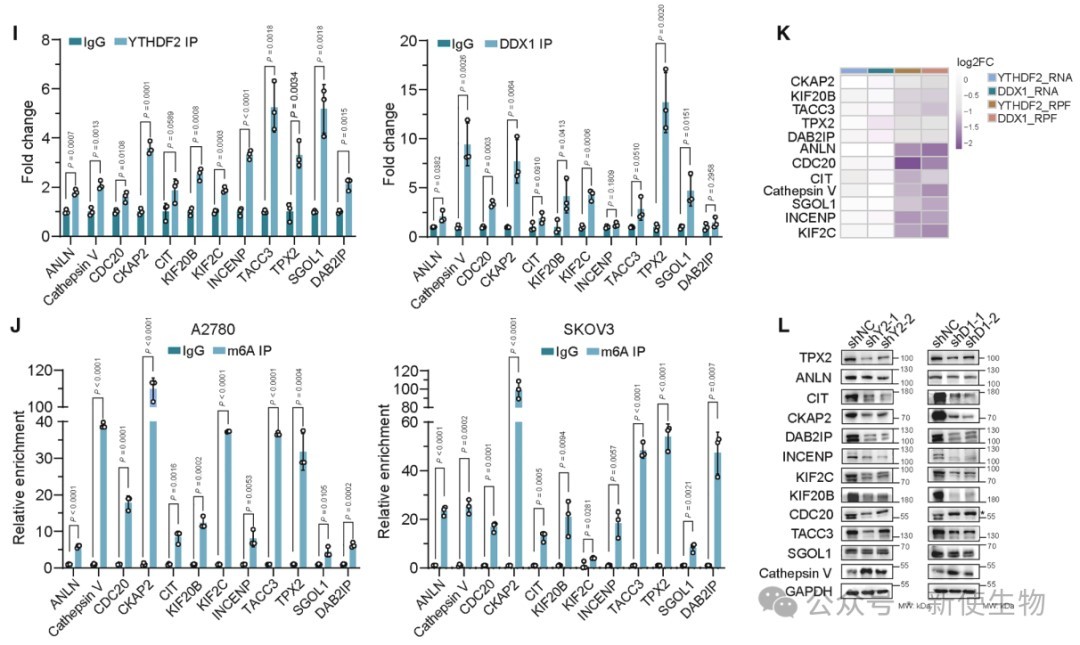
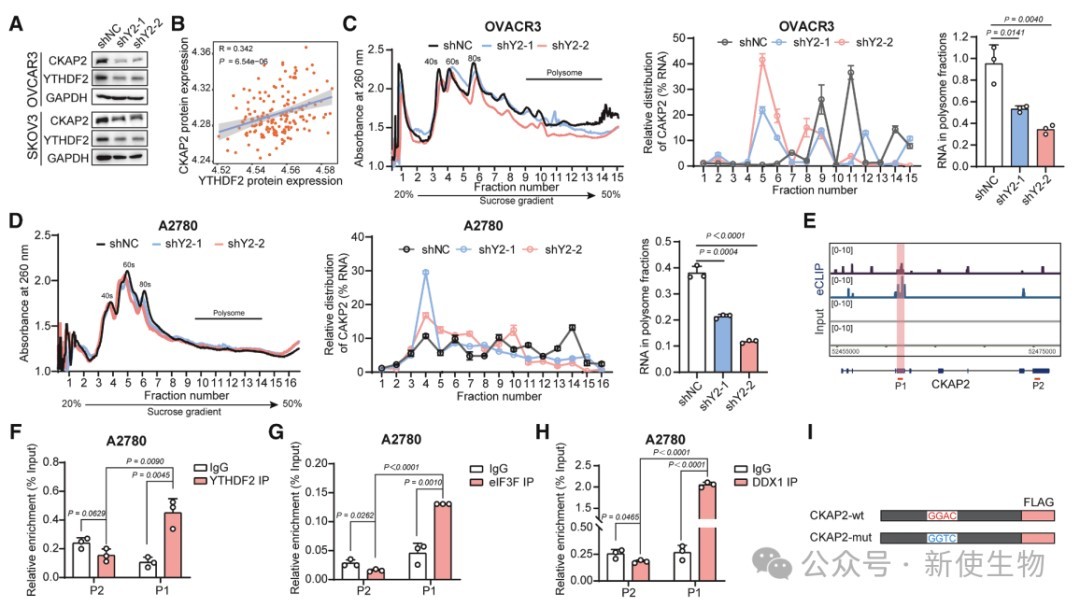
六. YTHDF2缺失抑制CKAP2翻译并增强卵巢癌细胞对紫杉醇的敏感性
YTHDF2通过结合CKAP2 mRNA的m6A位点促进其翻译,Polysome profiling多聚核糖体分析显示YTHDF2缺失减少CKAP2 mRNA在多聚核糖体上的富集。
CKAP2蛋白下降抑制OC细胞增殖和转移,且YTHDF2敲低增强紫杉醇疗效,说明YTHDF2-CKAP2轴促进卵巢癌进展。
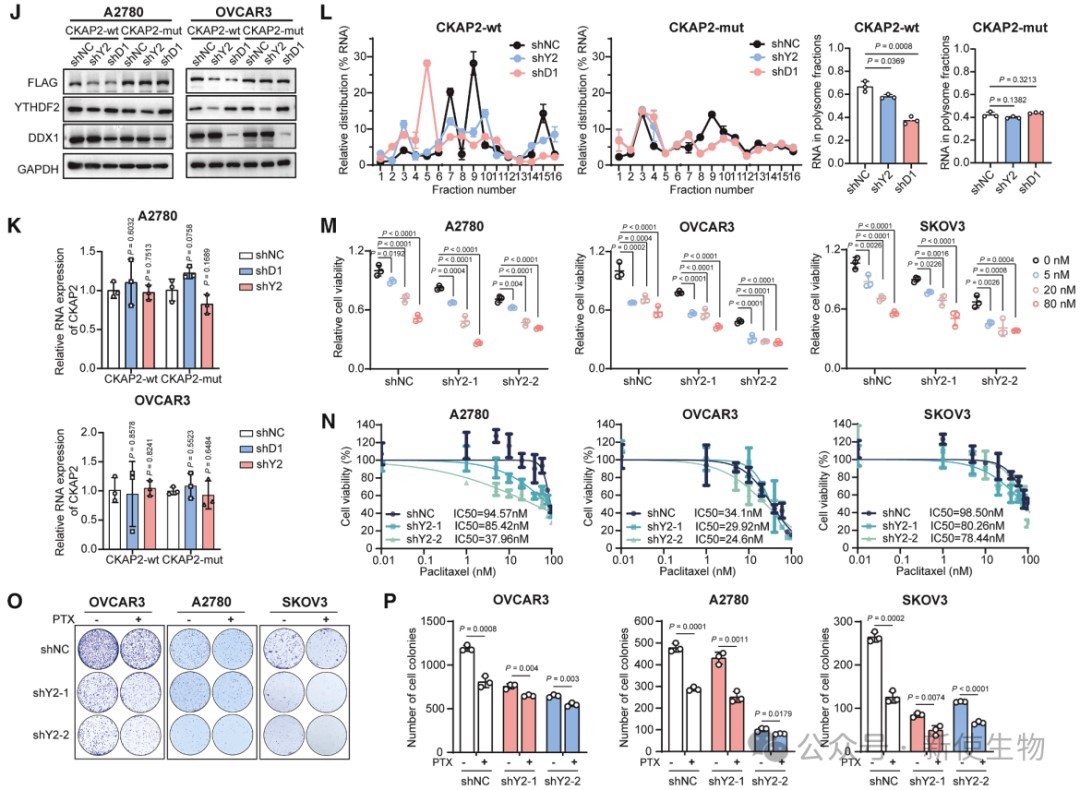
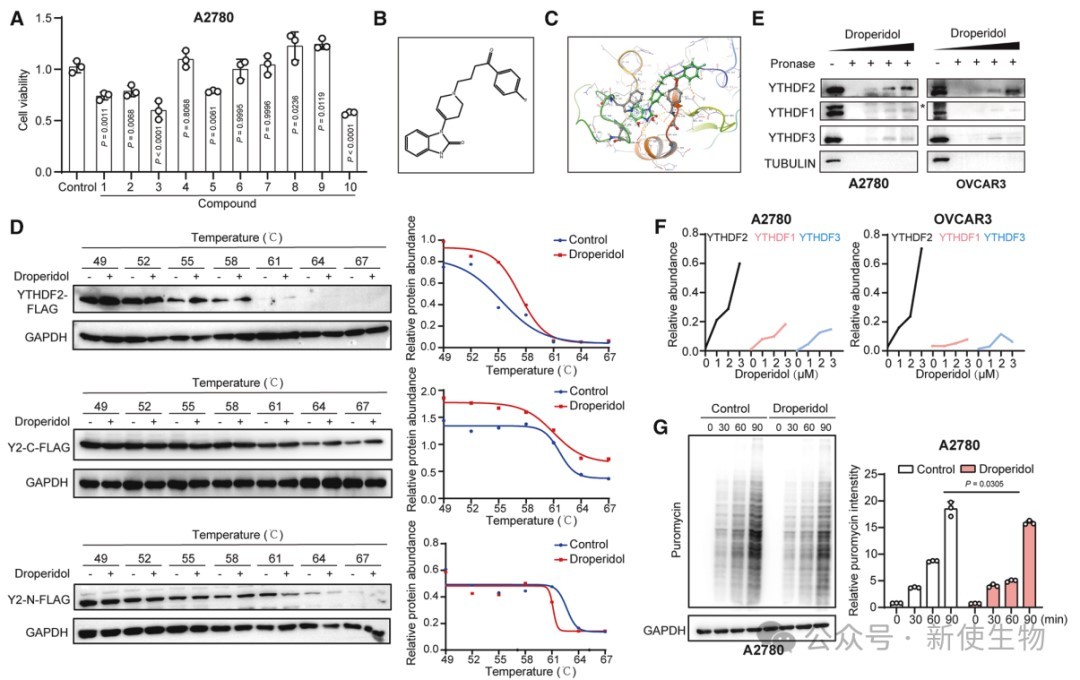
七. 小分子抑制剂靶向YTHDF2延缓卵巢癌进展
研究团队通过高通量筛选发现小分子多潘立酮可特异性靶向YTHDF2。
Polysome profiling多聚核糖体分析证实,多潘立酮抑制了卵巢癌细胞中CKAP2的翻译,降低细胞增殖和迁移能力。它还能阻断YTHDF2与DDX1、eIF3F的结合,削弱YTHDF2对目标mRNA的作用。
多潘立酮与紫杉醇联用增强了抗癌效果,显示其作为YTHDF2抑制剂的潜力,有望用于卵巢癌治疗。
总结
本研究发现YTHDF2除促进RNA降解外,还通过与eIF3F和DDX1相互作用,增强卵巢癌细胞中微管相关蛋白mRNA的翻译,促进肿瘤进展并降低紫杉醇敏感性。另外,文章发现的小分子抑制剂靶向YTHDF2,能抑制蛋白翻译并逆转耐药。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们