人口快速老龄化,神经退行性疾病如痴呆、帕金森和ALS发病率随年龄增长显著增加,成为重要公共卫生挑战。这些疾病导致神经元功能衰退,症状严重且治疗成本高,严重影响老年人生活质量。
虽然研究学者发现了一些相关生物标志物,但大多数病例无家族史或明确致病突变,且症状多晚发,表明衰老是关键因素。衰老影响神经元多种分子过程,如蛋白质聚集、能量代谢障碍和蛋白错误定位,但这些变化间的相互作用及其对疾病的具体贡献尚不清楚。
以RNA结合蛋白TDP-43为例,虽然其在大多数ALS患者中形成异常聚集,但其错误定位机制及无突变时的聚集过程仍未明了。此外,RNA生物学的失调与衰老神经元的关系也需进一步探索。

研究结果
作者构建了衰老神经元模型,发现其保留衰老标记。尽管RBP转录水平不变,蛋白水平显著下调,RNA代谢通路受损,而代谢相关通路上调,提示衰老神经元优先支持能量代谢,导致RNA稳态失衡。
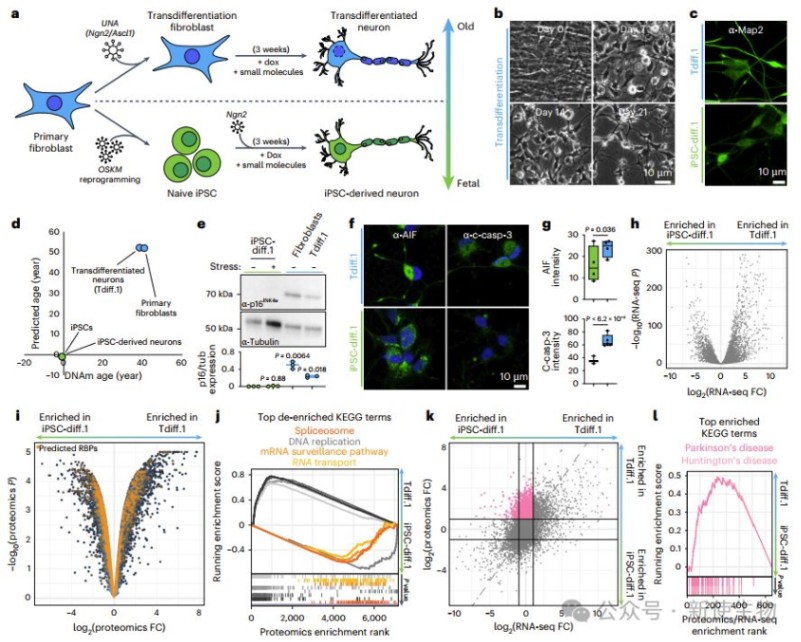
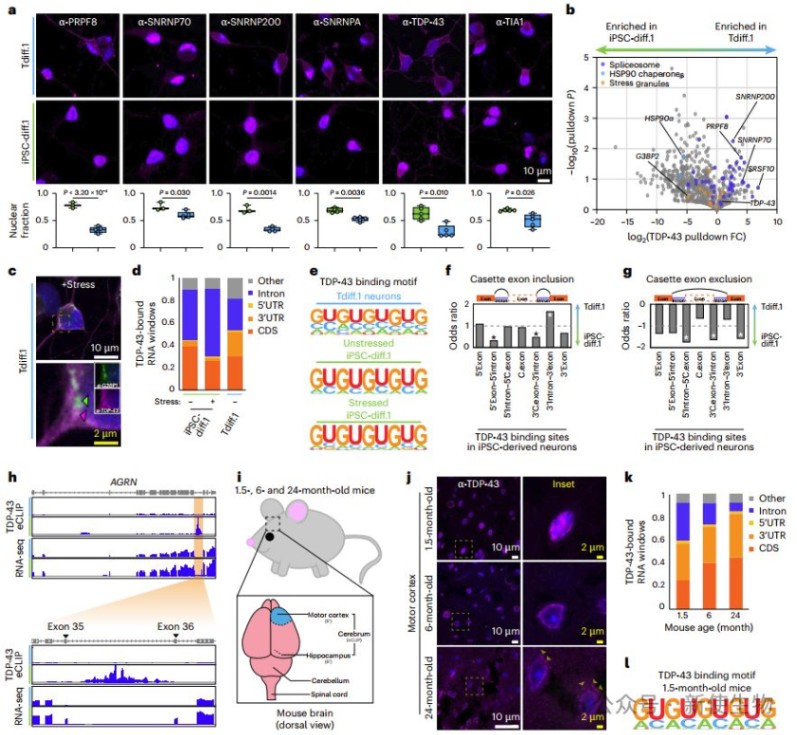
研究发现,在转分化的衰老神经元中,多个剪接体蛋白(如TDP-43、PRPF8、SNRNP70等)从细胞核错误定位到胞质,TDP-43并形成异常聚集,而这种现象未在年轻细胞中观察到。
eCLIP数据显示,TDP-43在老化神经元中对内含子的结合显著减少,导致多个关键神经元基因(如AGRN、DNM1、MAPT)发生异常剪接。
小鼠实验证实这种TDP-43错位及功能缺失是衰老相关过程,可能促进神经退行性疾病发生。
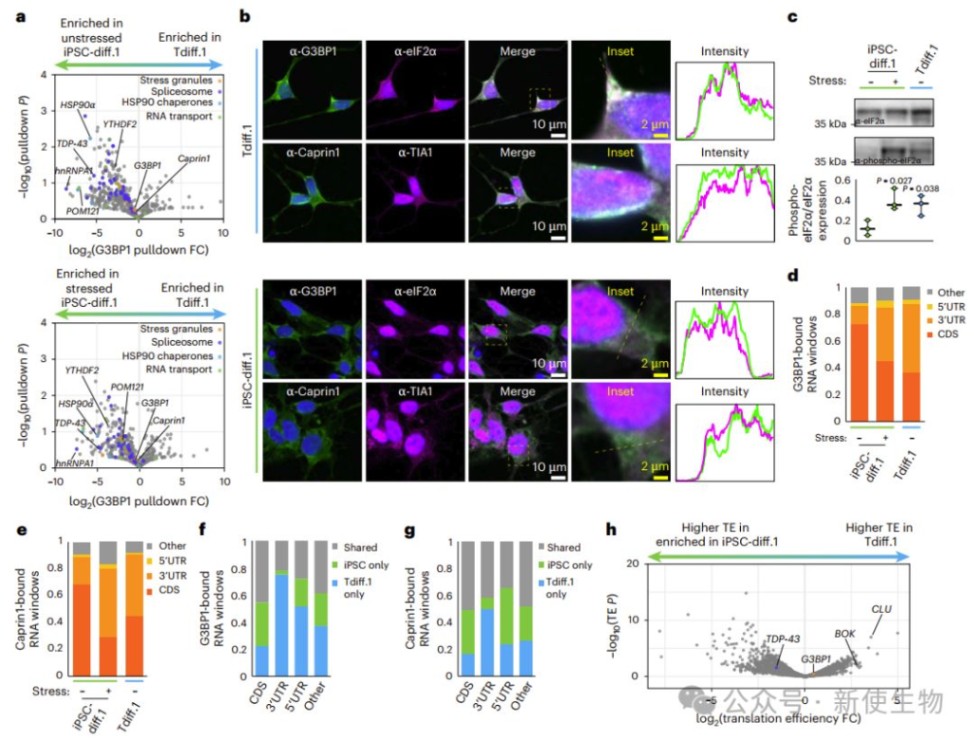
转分化的衰老神经元中,剪接体蛋白与典型应激颗粒分离,形成独立异常聚集体。应激颗粒标志蛋白G3BP1和Caprin1在未受刺激状态下异常聚集,显示慢性应激反应。
作者通过Ribo-seq核糖体印迹分析发现,衰老神经元中数千种转录本的翻译效率(TE)下降,但应激颗粒结合的转录本翻译效率无显著变化,说明慢性应激颗粒不直接抑制蛋白质合成。
总体表明,衰老神经元形成慢性应激颗粒,伴随慢性应激但不影响整体翻译。
HSP90α活性下降导致衰老神经元中应激颗粒难以消散,泛素化系统优先处理线粒体蛋白而非应激颗粒蛋白,造成慢性应激颗粒积累。
抑制HSP90α能减少这些颗粒,说明其功能异常加剧了神经元慢性应激。
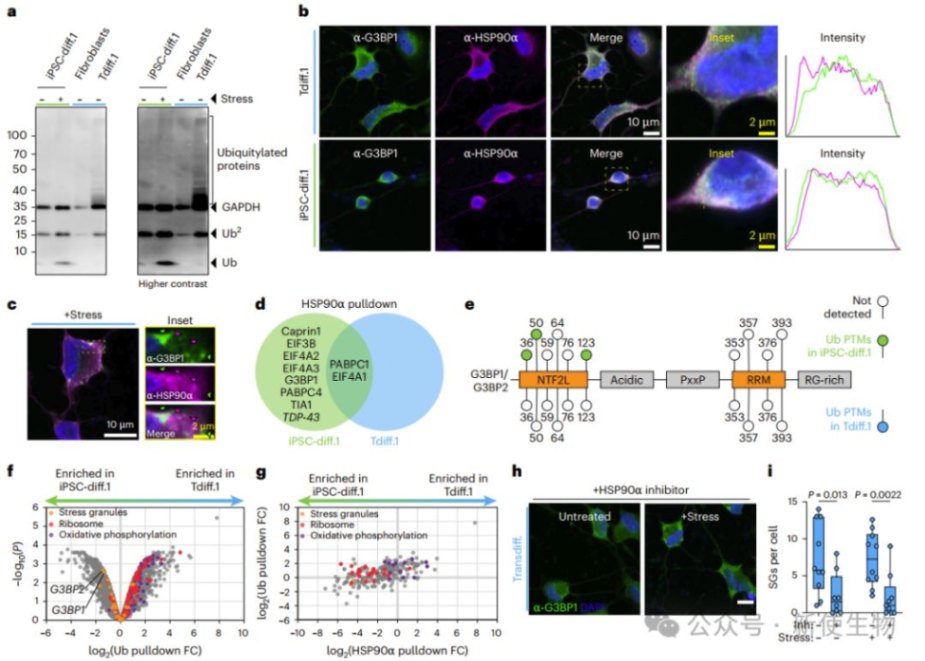
五. 慢性应激颗粒削弱对急性应激的响应
老化神经元中持续的应激反应削弱了它们对新急性应激的恢复能力。
实验显示,年轻神经元能快速清除应激颗粒并激活热休克蛋白基因,而老化神经元应激颗粒长期滞留,热休克蛋白激活不足,恢复能力差,可能导致老化神经元易损和衰亡。
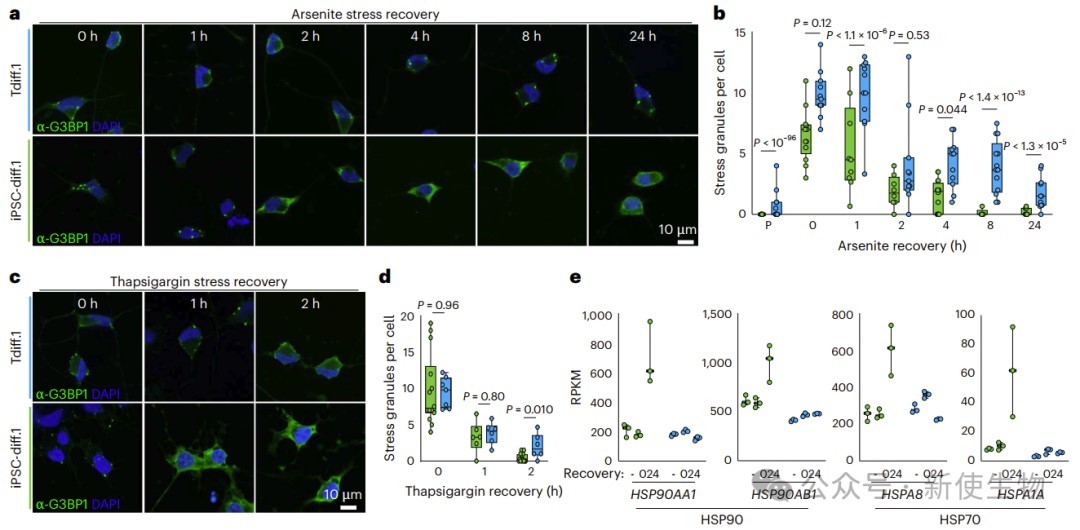
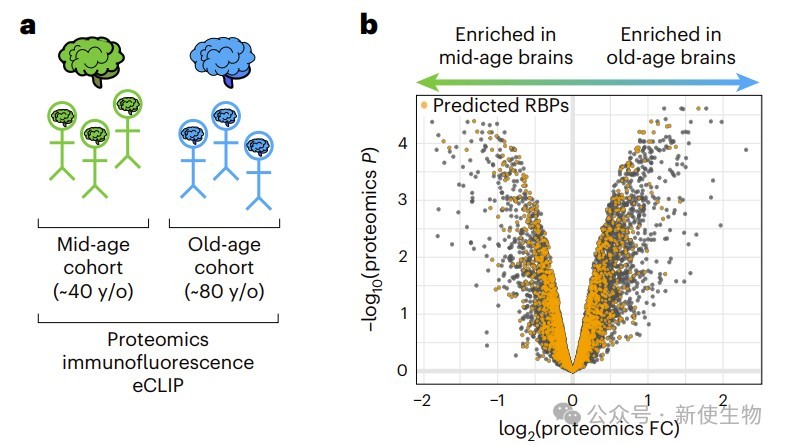
六. 衰老人脑的RNA生物学失调
团队在老年人脑额叶验证了转分化神经元中的关键衰老表型。
老年脑中线粒体蛋白上调,RNA结合蛋白下降,TDP-43细胞质聚集增加,磷酸化eIF2α升高,G3BP1对3′ UTR的结合增强,均显示分子应激状态。这些现象与细胞模型高度一致,说明模型能真实反映人脑衰老变化。
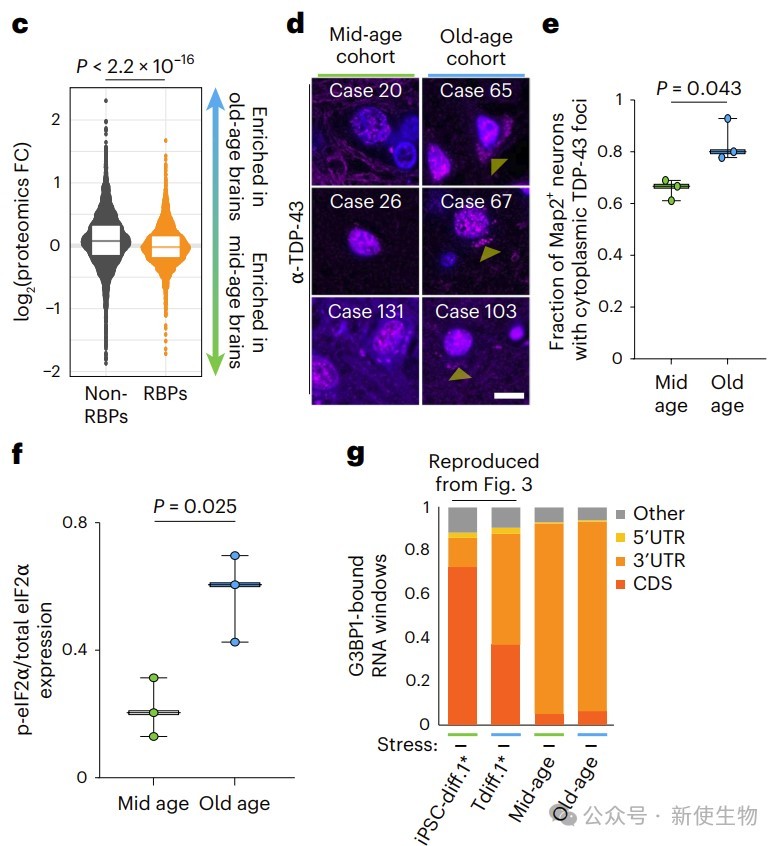
总结
本研究发现衰老导致神经元RNA结合蛋白减少,剪接蛋白如TDP-43异常定位细胞质,引发剪接紊乱。慢性细胞应激阻碍应激颗粒清除,原因包括泛素化和HSP90α功能失调,导致老年神经元抗逆能力下降。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们