导读
肌萎缩侧索硬化(ALS),俗称“渐冻症”,是一种致命的神经退行性疾病,其诊断过程漫长且充满挑战,患者从症状出现到死亡的中位生存期仅为2至3年。ALS的临床表现和预后存在显著的异质性,大部分ALS病例是散发性的,且病因仍然难以捉摸,目前尚无有效的治疗方法。
近年来,ALS样本的分子谱分析取得了显著进展,发现了一系列与ALS相关的基因。然而,这些基因的突变率在ALS人群中相对较低,且大多数ALS病例没有已知的驱动基因。
由于ALS患者死后组织稀缺且难以进行实验操作,因此缺乏能够重现其异质性的实验平台。患者来源的诱导多能干细胞(iPSCs)可以分化为运动神经元,并保留供体患者的遗传背景,为ALS提供了一个具有代表性的模型系统。
2025年8月7日,复旦大学邱志欣和王涛团队在Communications Biology上发表了一篇题为“Machine learning-based proteomics profiling of ALS identifies downregulation of RPS29 that maintains protein homeostasis and STMN2 level”的论文,首次鉴定出一个由110个蛋白组成的生物标志物组合(PMA110),核糖体蛋白RPS29的下调是部分ALS患者的关键病理特征,它通过抑制重要的运动神经元蛋白STMN2的翻译并扰乱整体蛋白质稳态,这一发现为ALS提供了新的潜在治疗靶点。

文章索引
【标题】Machine learning-based proteomics profiling of ALS identifies downregulation of RPS29 that maintains protein homeostasis and STMN2 level
【发表期刊】Communications Biology
【发表日期】2025年8月7日
【作者及团队】复旦大学邱志欣和王涛团队
【IF】5.1
研究结果
一、ALS队列和多组学数据集的分析流程
研究构建了一个整合的分析流程,用于分析Answer ALS(AALS)运动神经元的多组学数据集,包括机器学习算法、生物信息学分析和实验验证。
该数据集包含来自169名ALS患者和33名对照的样本,通过机器学习和共识聚类分析,鉴定出与ALS病理相关的蛋白质特征。
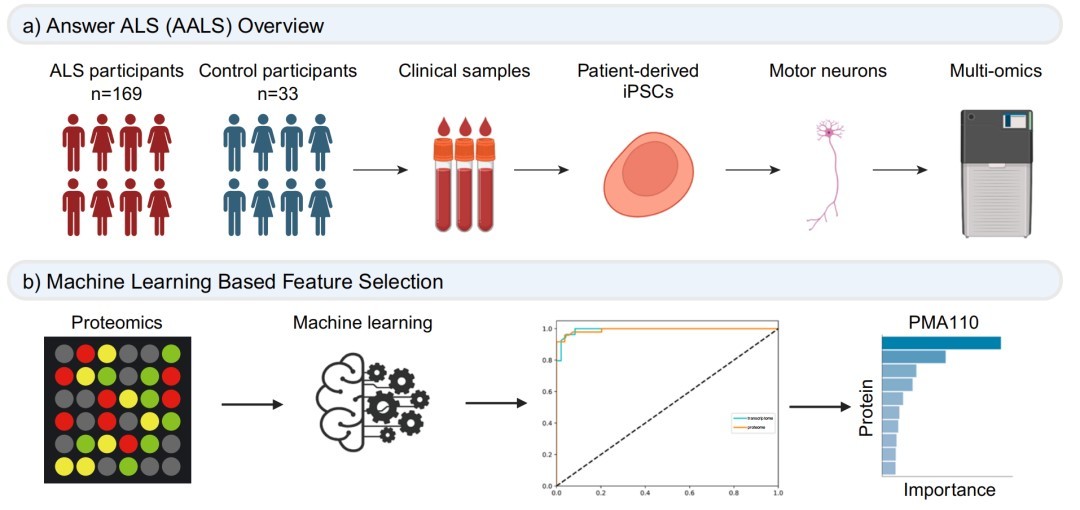
二、基于机器学习的ALS多组学数据集分析鉴定出110个与ALS相关的蛋白质标志物
研究使用机器学习方法,而非传统差异表达分析,生成了包含110个蛋白质特征的“肌萎缩性侧索硬化症110个蛋白质标记物(PMA110)”。
这些标记物与已知的ALS风险基因存在强烈的相互作用,PMA110特征的功能富集揭示ALS病理通路。
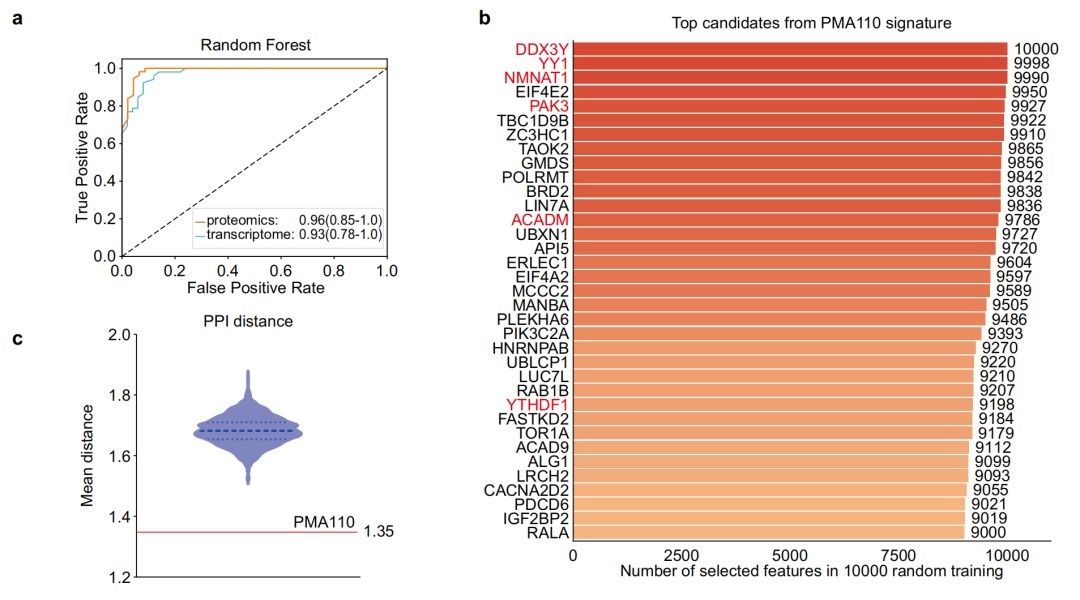
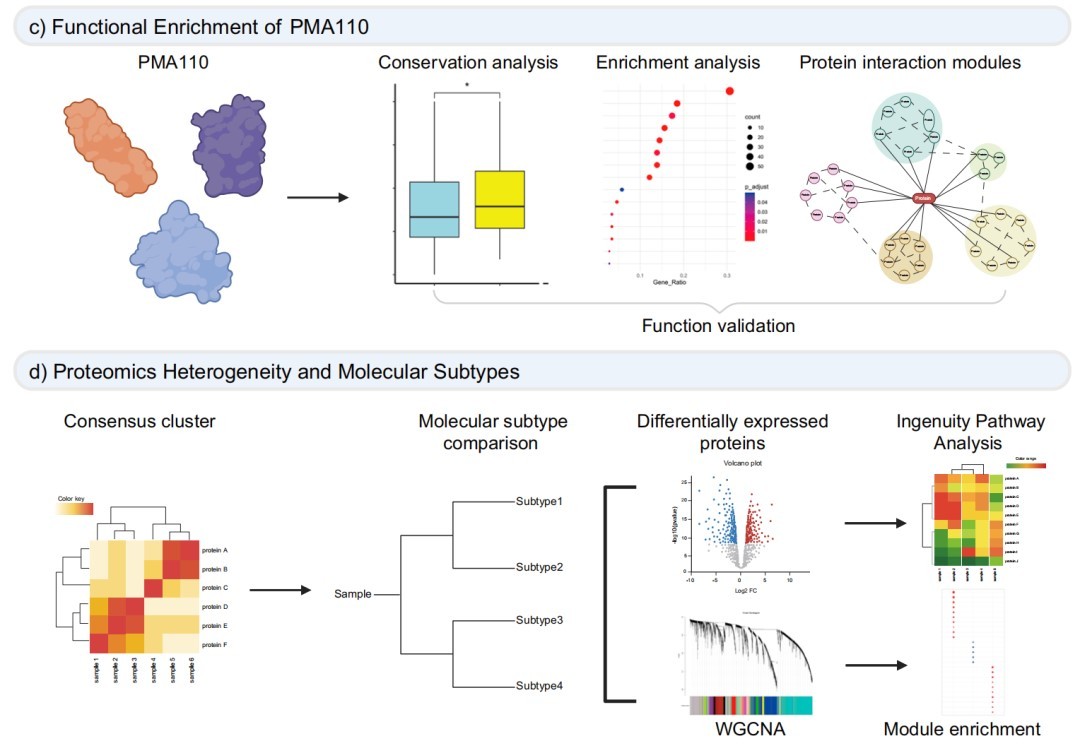
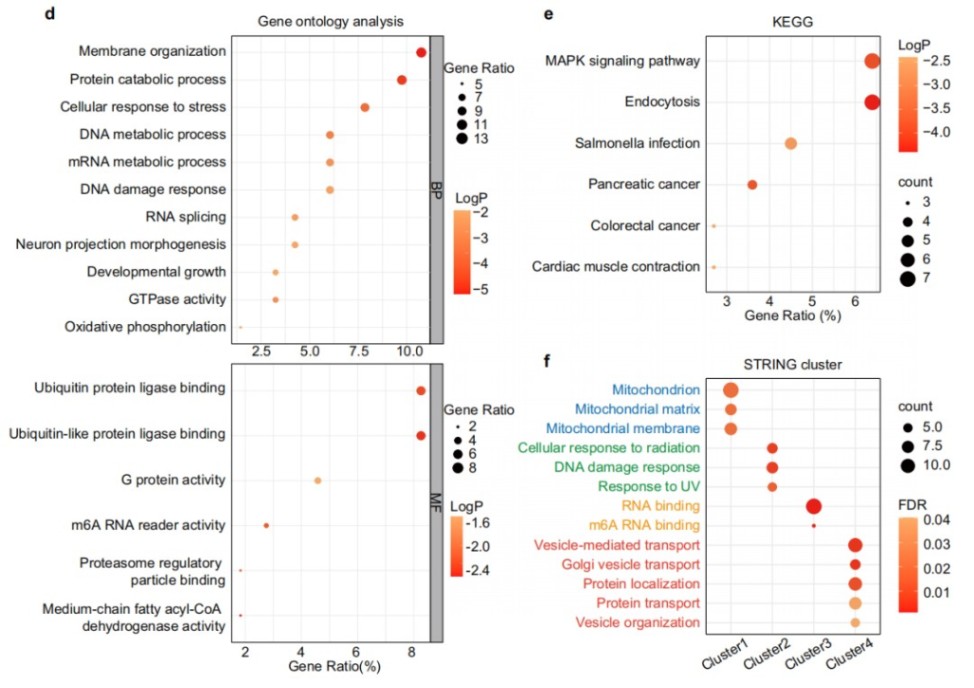
三、PMA110蛋白标记物的功能富集分析揭示了ALS的病理通路
功能富集分析显示,PMA110标记物富集于应激反应、氧化磷酸化、RNA代谢等与ALS病理相关的通路,并分为四个蛋白质-蛋白质相互作用(PPI)簇,进一步揭示了其功能重要性。
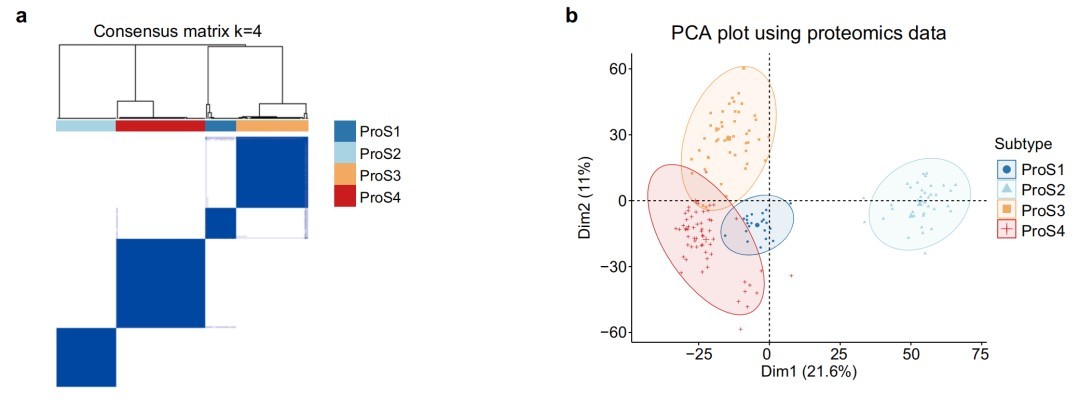
四、基于蛋白质组学的ALS亚型解决了患者间的分子异质性
基于蛋白质组学的共识聚类将患者分为四个亚型(ProS1-4),每个亚型都具有独特的蛋白质表达模式和临床相关性,这为解决ALS异质性问题提供了新的思路。
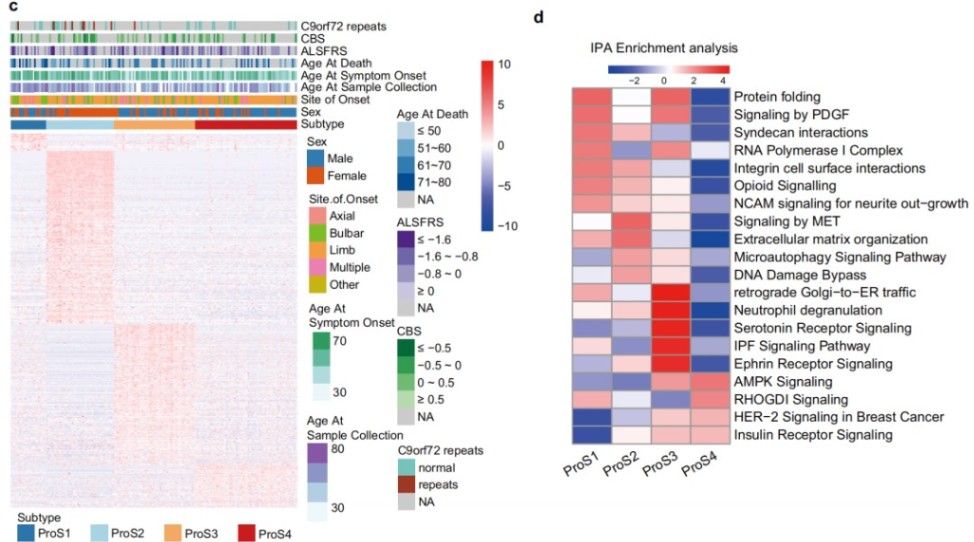
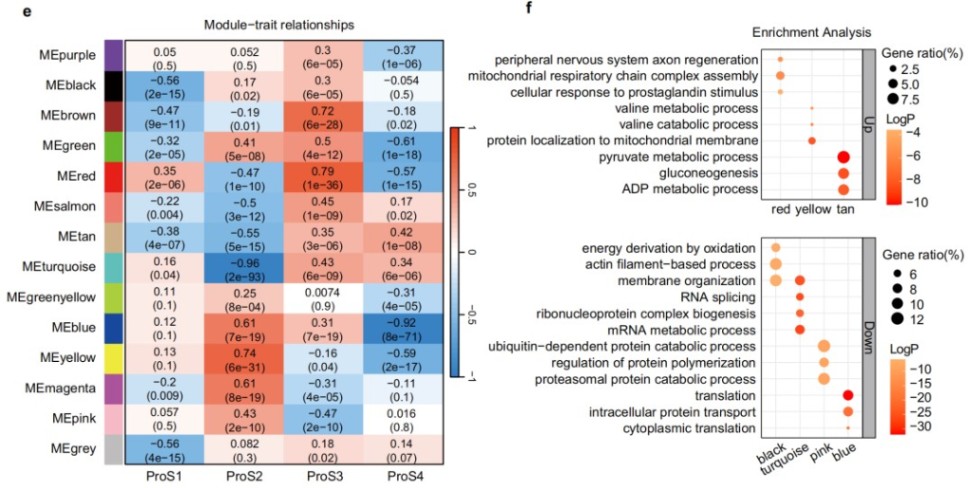
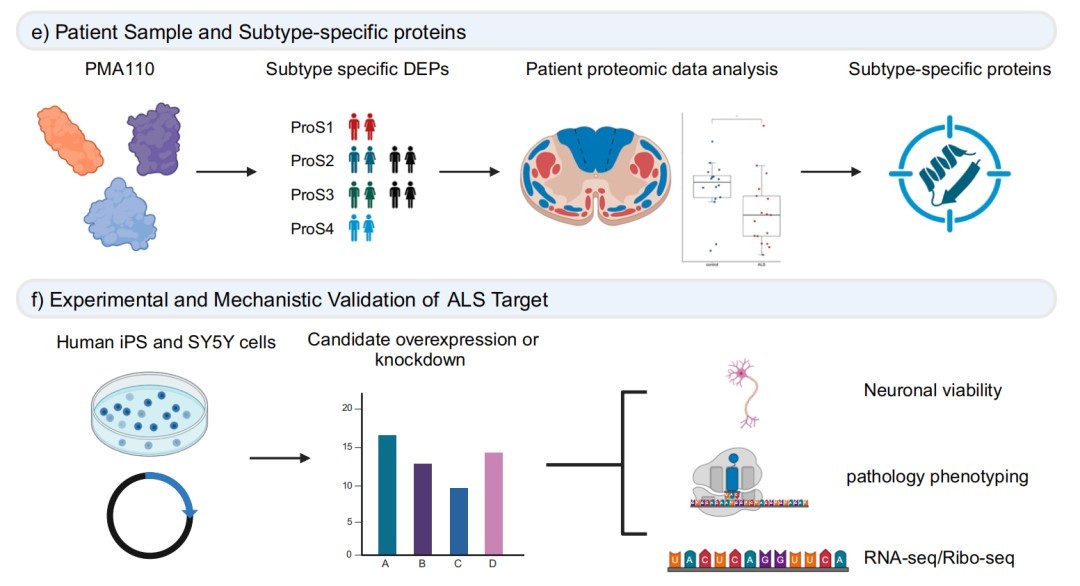
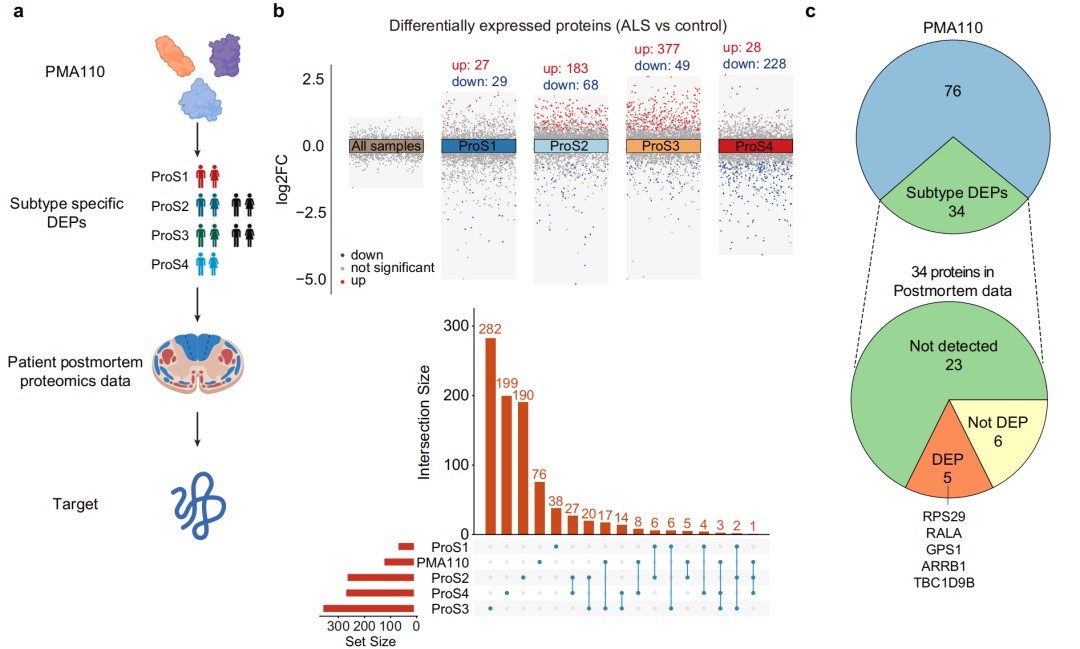
五、将AALS中的共识聚类与机器学习模型整合以鉴定ALS患者的亚型特异性靶点
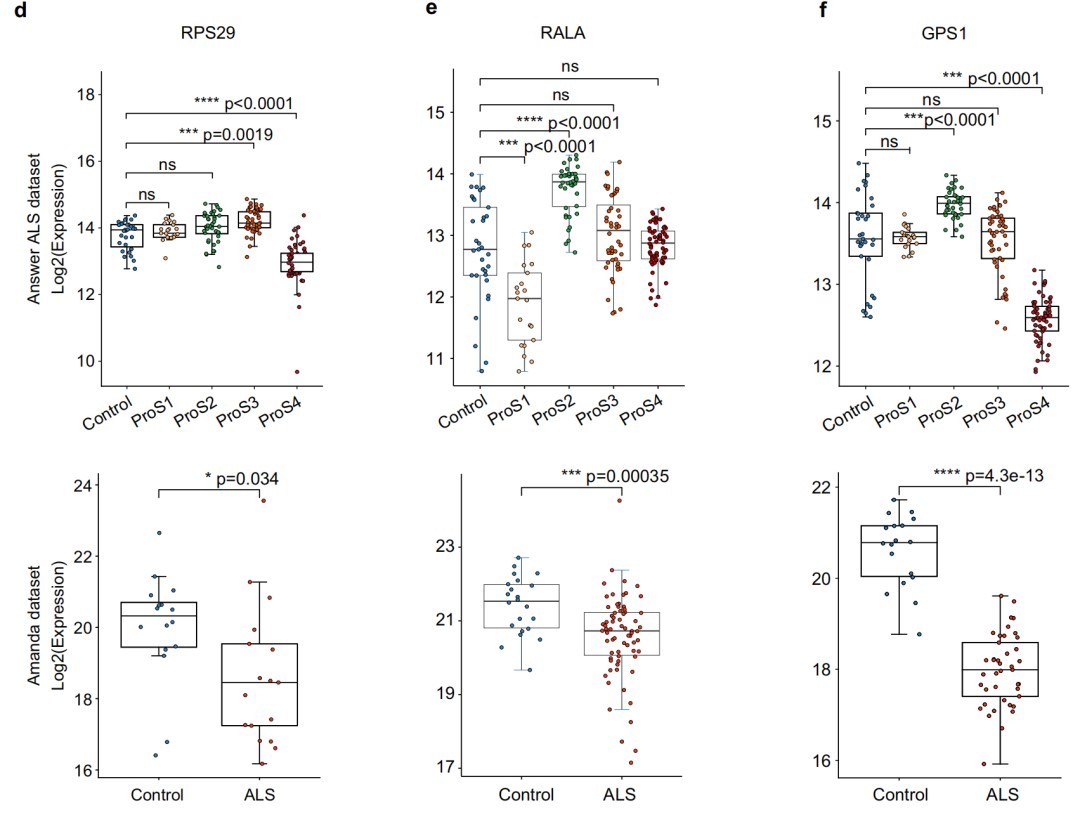
研究通过整合共识聚类和机器学习,鉴定出RPS29等亚型特异性候选蛋白,并选择RPS29进行深入的功能验证。
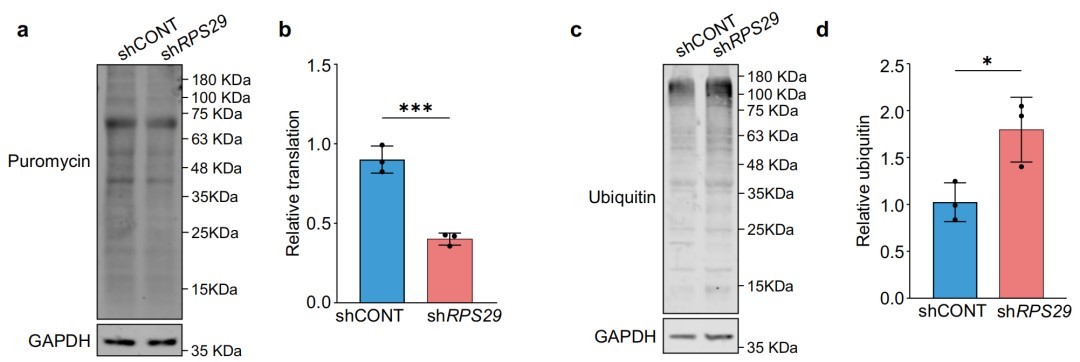
六、RPS29作为蛋白质翻译的质量控制调节因子
实验证明,RPS29敲低会显著降低蛋白质翻译速率,并增加翻译错误,从而破坏蛋白质稳态,导致神经元细胞死亡。
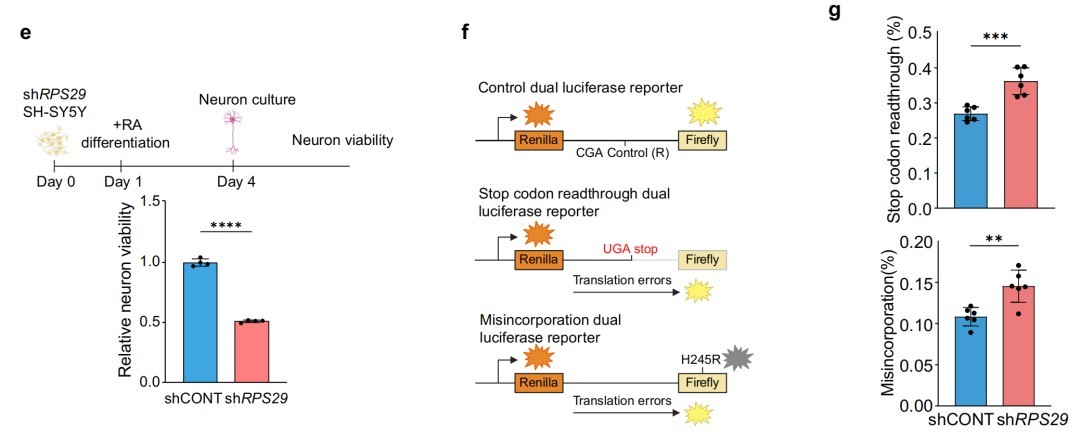
七、RPS29维持STMN2的翻译和蛋白表达
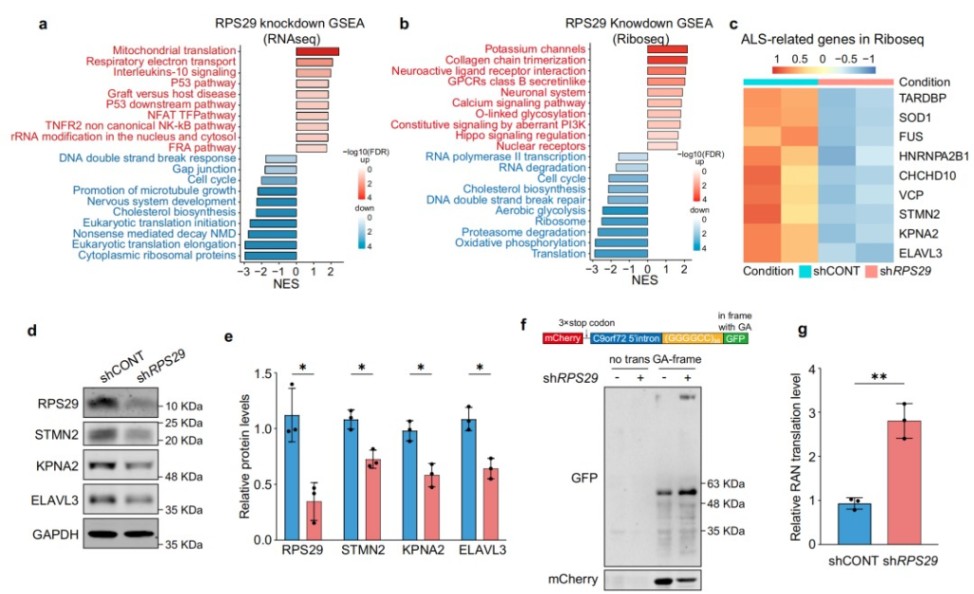
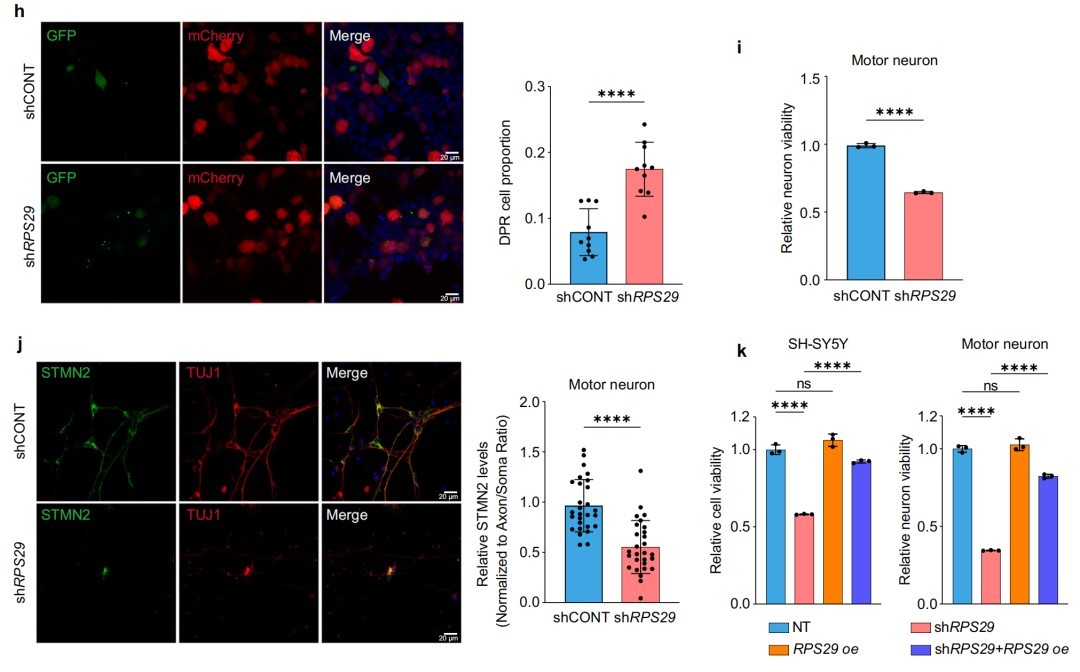
总结
本研究通过创新的机器学习框架,成功地从复杂的ALS蛋白质组数据中识别出一组新的生物标志物,并揭示了核糖体蛋白RPS29在ALS病理中的核心作用。该研究不仅将RPS29的下调与关键蛋白STMN2的缺失联系起来,还为特定ALS亚型的患者提供了一个极具潜力的治疗新靶点。
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们