导读
神经母细胞瘤(Neuroblastoma)是一种源于分化停滞的神经嵴细胞的高度致死性儿童肿瘤。MYCN原癌基因的扩增是侵袭性神经母细胞瘤的标志,其通过上调多胺合成途径中的限速酶ODC来驱动肿瘤生长。
针对这一特性,ODC抑制剂二氟甲基鸟氨酸(DFMO)已显示出临床疗效,并于近期获批用于高危神经母细胞瘤的治疗。开发能够增强DFMO活性的联合治疗策略具有重要的临床意义。
一个潜在的策略是耗竭ODC的作用底物鸟氨酸,而鸟氨酸主要由精氨酸和脯氨酸等上游氨基酸转化而来。因此,通过饮食限制这些前体氨基酸是一种极具前景的探索方向。
2025年9月24日,苏黎世大学儿童医院Raphael J. Morscher团队、普林斯顿大学Joshua D. Rabinowitz团队与费城儿童医院Michael D. Hogarty团队合作,在Nature上发表了题为“Reprogramming neuroblastoma by diet-enhanced polyamine depletion”的论文。该研究发现无精氨酸和脯氨酸饮食能够显著增强DFMO对肿瘤内多胺的耗竭,进而通过一种前所未见的密码子特异性翻译重编程机制,抑制癌基因翻译并诱导肿瘤分化。

文章索引
【标题】Reprogramming neuroblastoma by diet-enhanced polyamine depletion
【发表期刊】Nature
【发表日期】2025年9月24日
【作者及团队】苏黎世大学儿童医院Raphael J. Morscher团队、普林斯顿大学Joshua D. Rabinowitz团队与费城儿童医院Michael D. Hogarty团队
【IF】48.5
研究结果
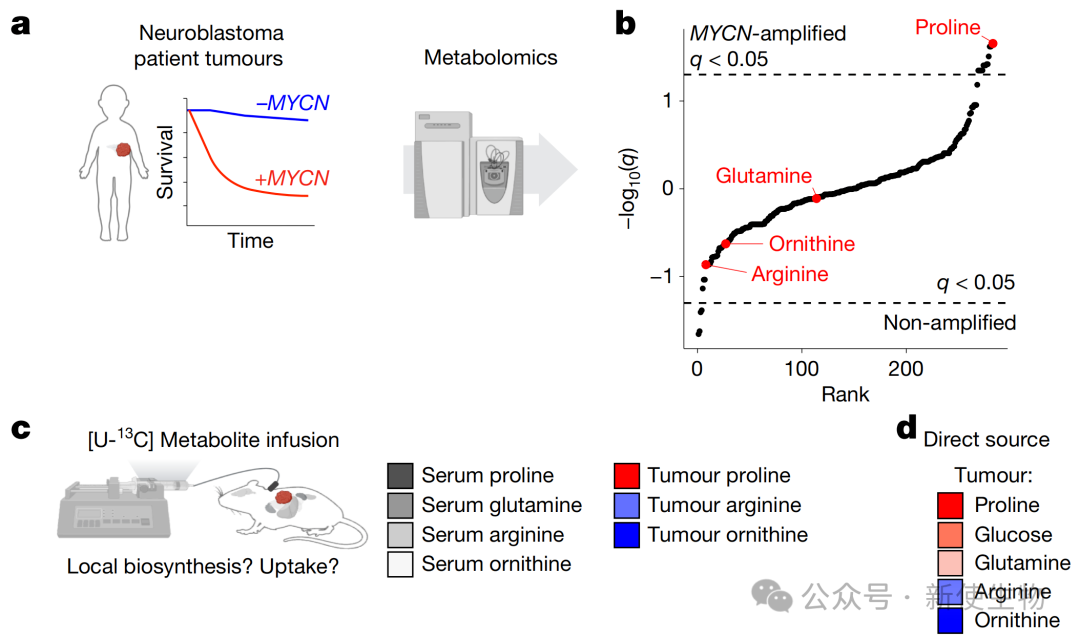
一、MYCN驱动的神经母细胞瘤依赖循环系统获取多胺前体
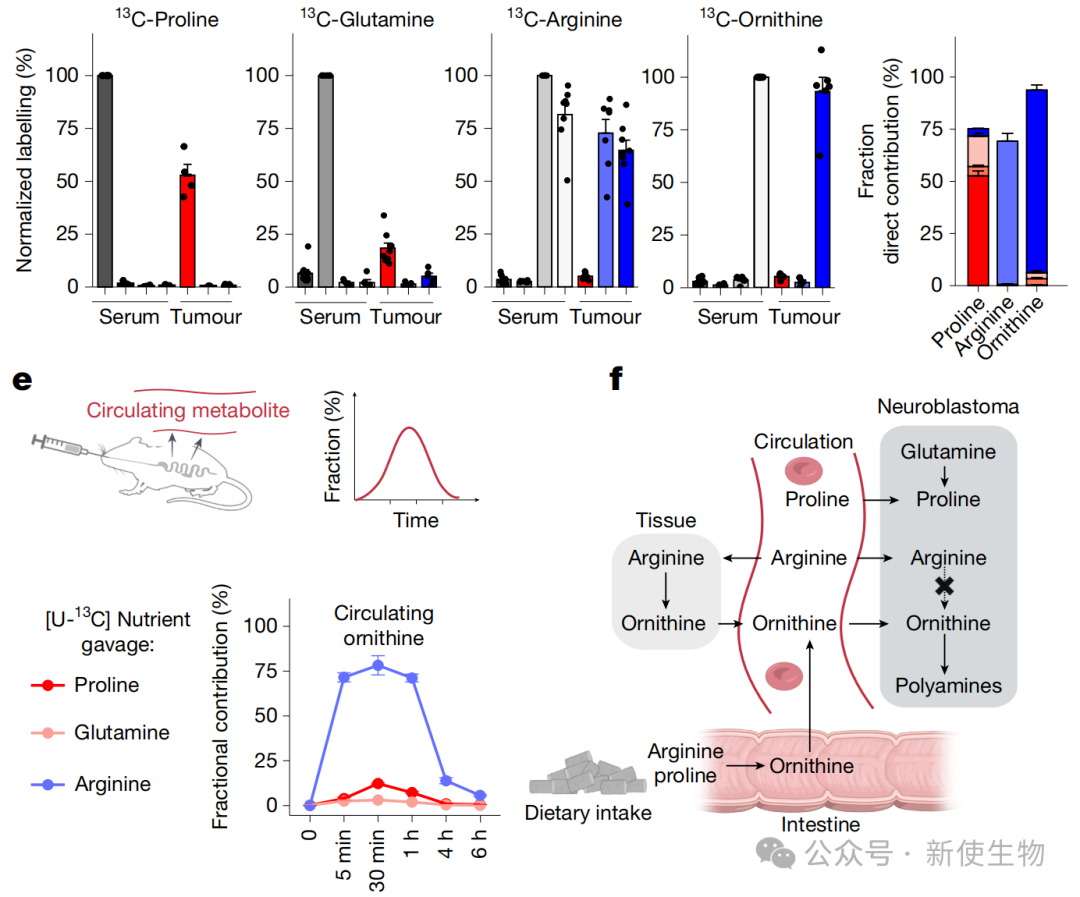
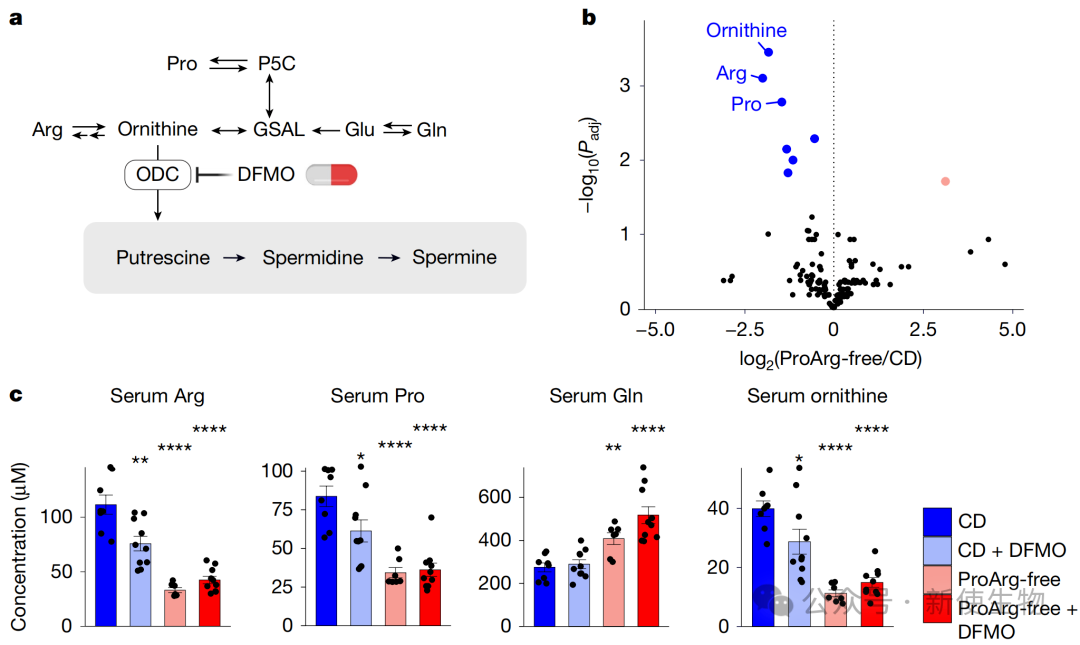
通过代谢组学和稳定同位素示踪技术,研究团队发现MYCN扩增的神经母细胞瘤富含脯氨酸。
然而,其合成多胺所需的关键前体鸟氨酸主要依赖从循环系统中摄取,而非在肿瘤内部合成,循环中的鸟氨酸主要来源于精氨酸。
二、无脯氨酸和精氨酸饮食联合DFMO显著抑制肿瘤并延长生存期
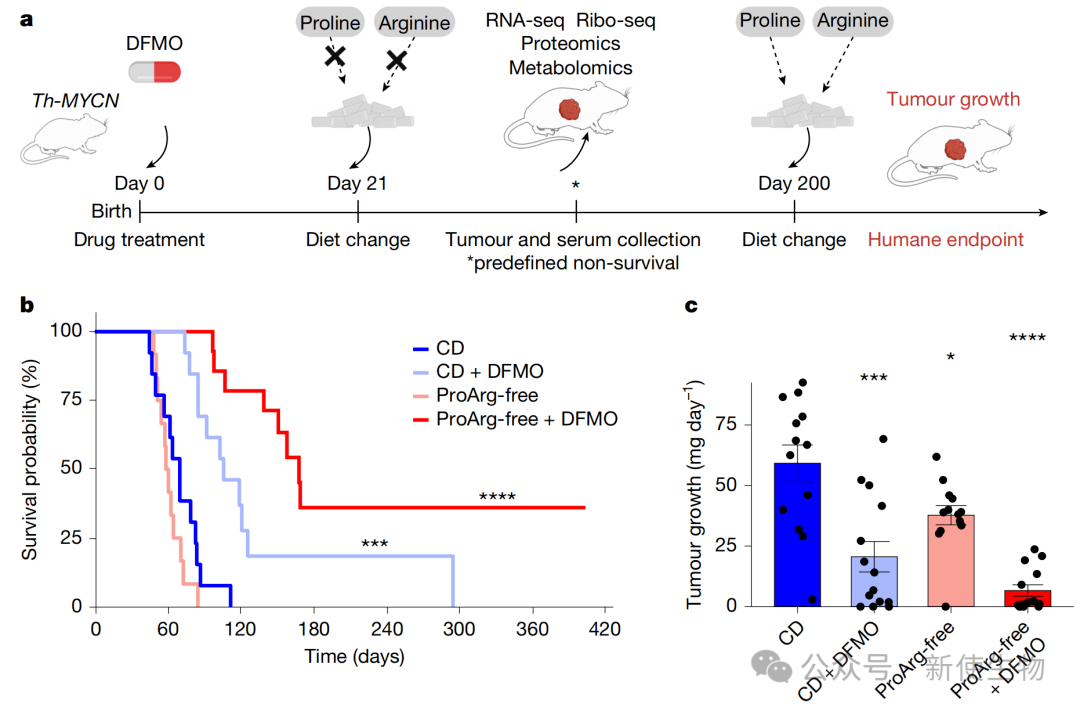
基于上述发现,研究人员在神经母细胞瘤小鼠模型(Th-MYCN)中测试了无精氨酸和脯氨酸(ProArg-free)饮食联合DFMO的疗效。
结果显示,联合治疗组的肿瘤生长被显著抑制,小鼠生存期大幅延长,这一疗效远优于任何单一疗法。
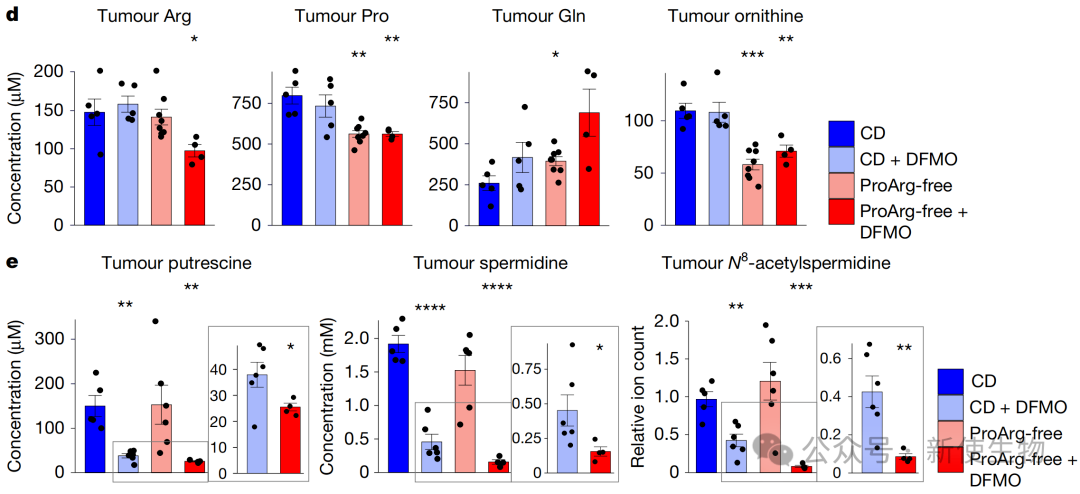
三、联合疗法加剧肿瘤内的多胺耗竭
代谢组学分析显示,ProArg-free饮食显著降低了血清和肿瘤组织中鸟氨酸的水平。
当饮食限制与DFMO药物联用时,这种效应被急剧放大,导致肿瘤内的多胺(特别是亚精胺)水平的急剧下降,其耗竭程度远超单用DFMO的效果。
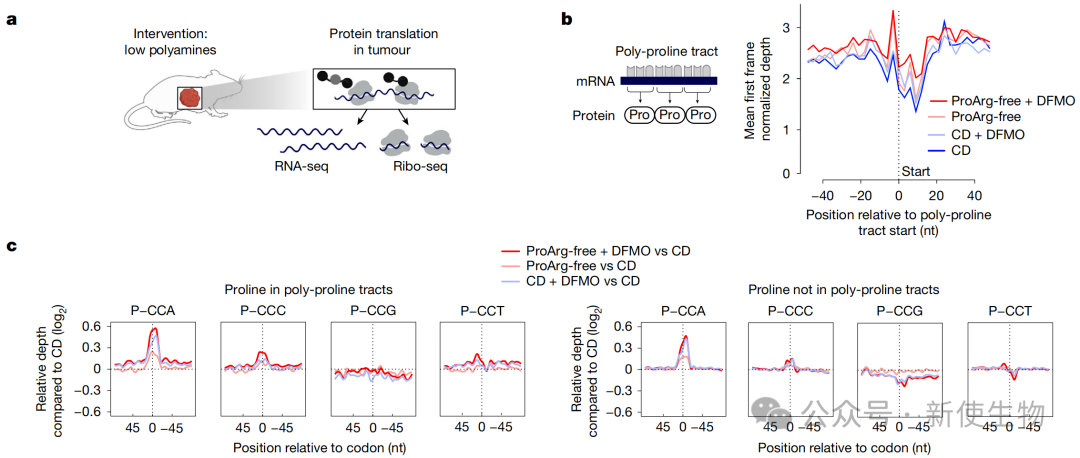
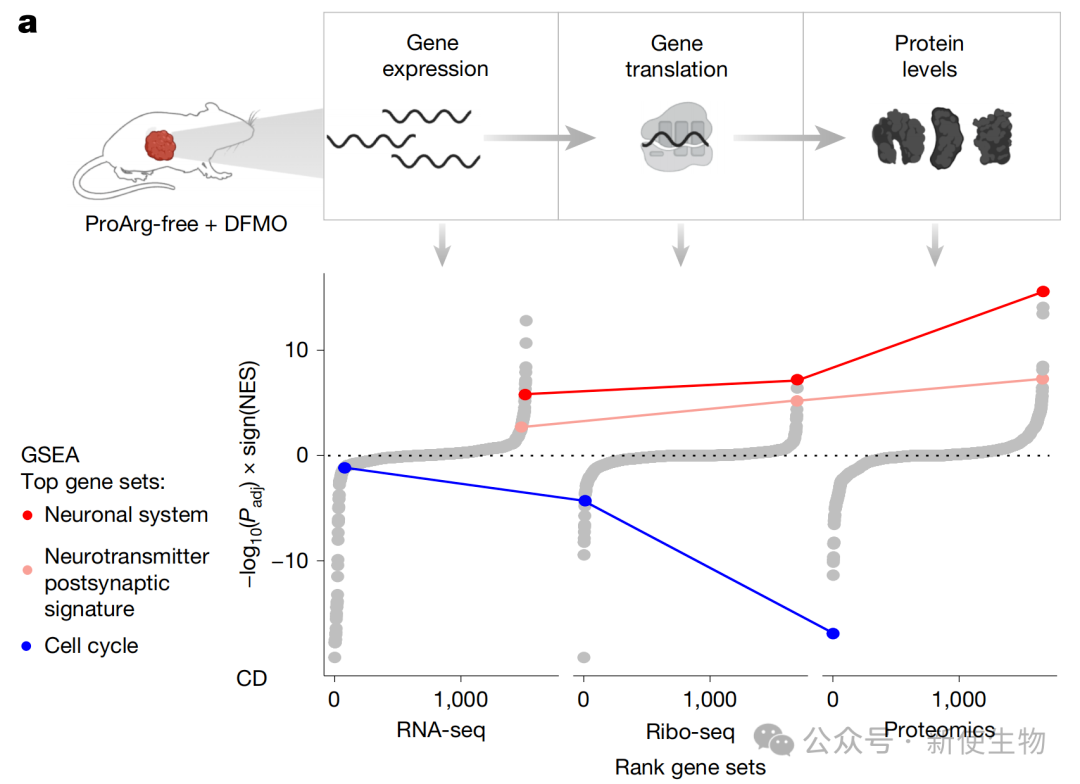
四、多胺耗竭在密码子水平诱导了特异性翻译缺陷
通过Ribo-seq核糖体印迹分析,研究团队发现ProArg-free饮食联合DFMO导致的多胺水平显著下降会引起核糖体翻译过程中的停滞。
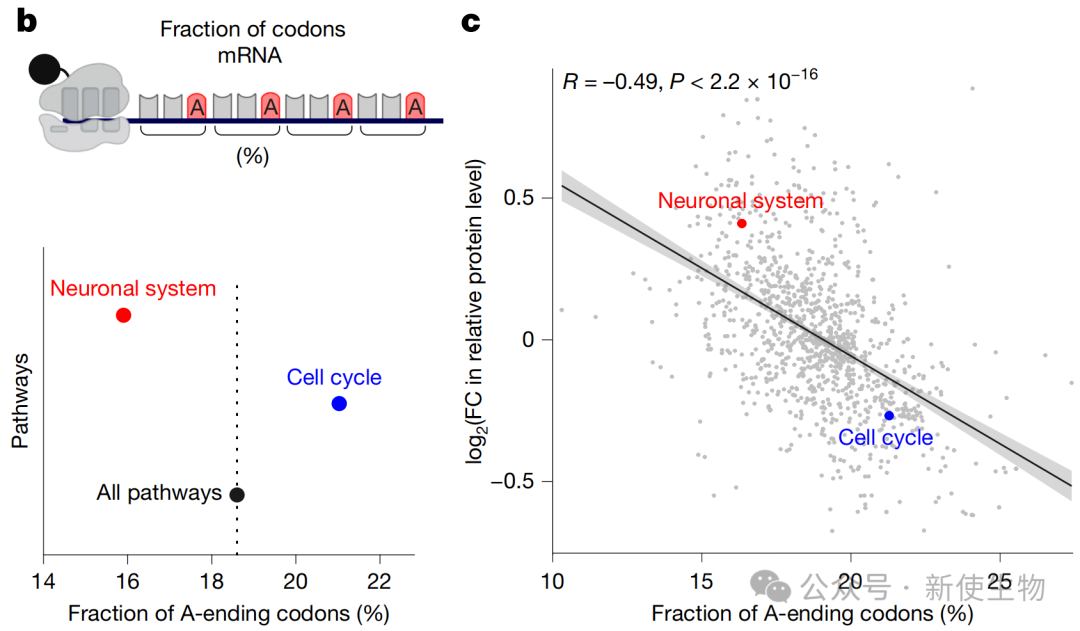
然而,这种停滞并非发生在脯氨酸密码子上,而是特异性地发生在所有以腺苷酸结尾的密码子上。
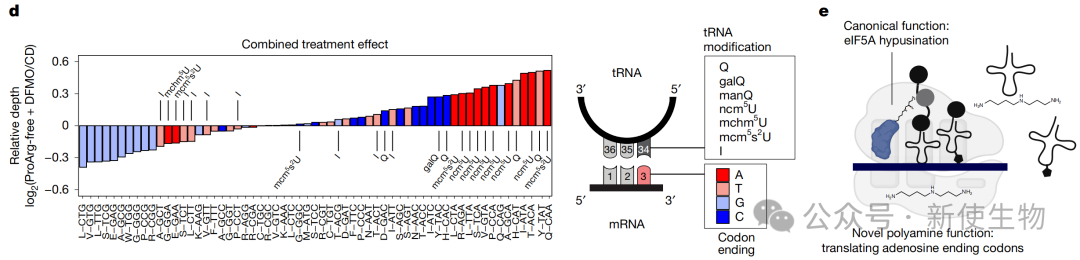
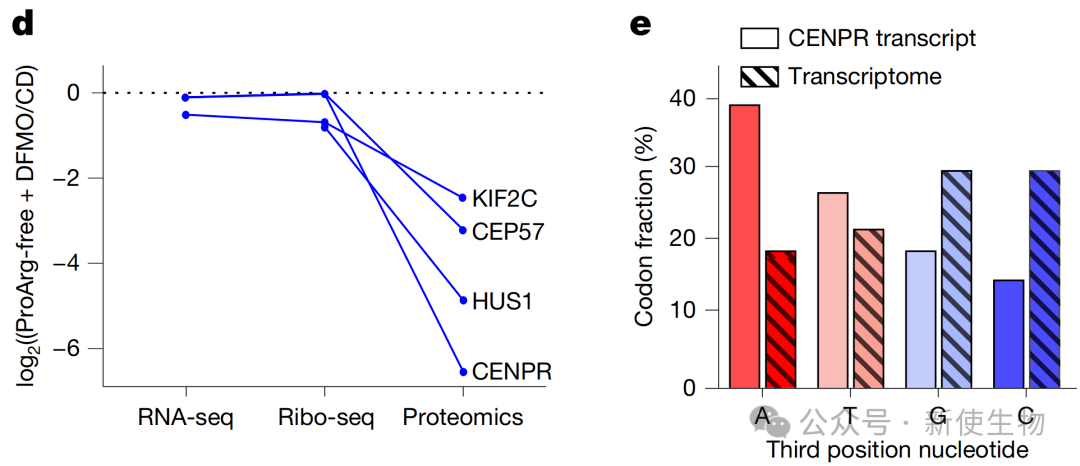
五、密码子偏好性驱动了从增殖到分化的蛋白质组重编程
通过整合RNA-seq、Ribo-seq核糖体印迹分析和蛋白质组学数据,作者发现细胞周期相关基因的mRNA序列中富含以A结尾的密码子,而神经分化相关基因则显著缺乏此类密码子。
因此,联合疗法诱导的密码子特异性翻译缺陷,选择性地抑制了细胞周期蛋白的合成,同时相对促进了分化相关蛋白的表达。
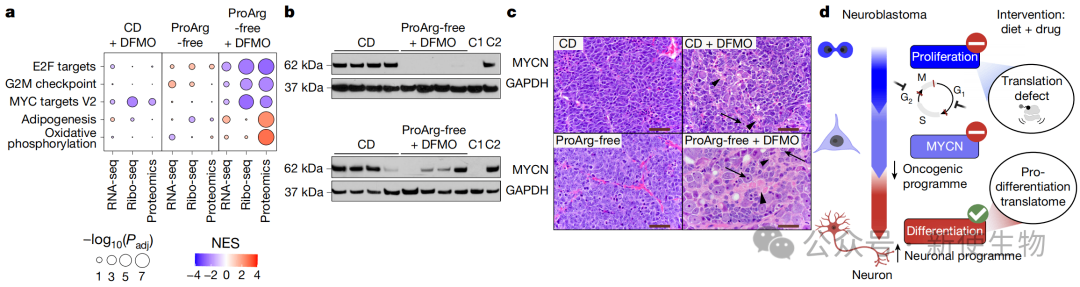
六、联合疗法通过蛋白质组重编程诱导神经母细胞瘤分化
该疗法导致的蛋白质组重编程显著抑制了肿瘤细胞的增殖,并下调了MYCN癌蛋白及其核心调控网络。
组织学分析证实,经联合治疗的肿瘤表现出明显的神经分化特征,从未分化的原始神经母细胞转变为具有丰富神经毡(neuropil)的分化细胞。
总结
本研究揭示了一种通过饮食与药物联合干预,靶向肿瘤代谢并诱导其分化的创新治疗策略。研究发现多胺水平与密码子特异性翻译之间存在前所未知的联系,并巧妙地利用了不同基因程序在密码子使用上的进化偏好,为治疗以分化停滞为特征的儿童癌症开辟了通过重编程蛋白质组实现分化治疗的新途径。
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com。
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们