导读
RNA结合蛋白的异常是多种神经退行性疾病,如肌萎缩侧索硬化(ALS)和额颞叶痴呆(FTD)的核心病理特征。在这些疾病中,TDP-43蛋白从细胞核内消失并于细胞质中异常聚集,是导致神经元死亡的关键事件。
长久以来,TDP-43的核内功能缺失被认为主要通过引发“隐匿性剪接”(cryptic splicing)而导致关键蛋白(如STMN2)的表达量下降,从而损害神经元功能。然而,TDP-43功能缺失是否会引发其他类型的RNA加工异常,特别是选择性多聚腺苷酸化(APA)的紊乱,一直未被系统性地研究。
2025年10月21日,伦敦大学学院Pietro Fratta与Maria Secrier团队在Nature Neuroscience上发表了一篇题为“TDP-43 loss induces cryptic polyadenylation in ALS/FTD”的论文。该研究开发了一种创新的生物信息学分析流程,首次系统性地揭示了TDP-43的核内缺失会广泛诱导“隐性多聚腺苷酸化”(cryptic APA)事件的发生。

文章索引
【标题】TDP-43 loss induces cryptic polyadenylation in ALS/FTD
【发表期刊】Nature Neuroscience
【发表日期】2025年10月21日
【作者及团队】伦敦大学学院Pietro Fratta与Maria Secrier团队
【IF】20.0
研究结果
一、TDP-43缺失广泛诱导神经元中的隐性APA事件
研究团队开发了一套新的生物信息学流程,能够从RNA-seq数据中可靠地鉴定出选择性末端外显子(ALE)、3' UTR延伸(3' Ext)和内含子多聚腺苷酸化(IPA)等多种APA事件。
通过分析一系列TDP-43敲低的iPSC衍生神经元数据,作者发现TDP-43的缺失会诱导大量“隐性”APA事件的发生,即在正常细胞中几乎不使用的多聚腺苷酸化位点被异常激活。
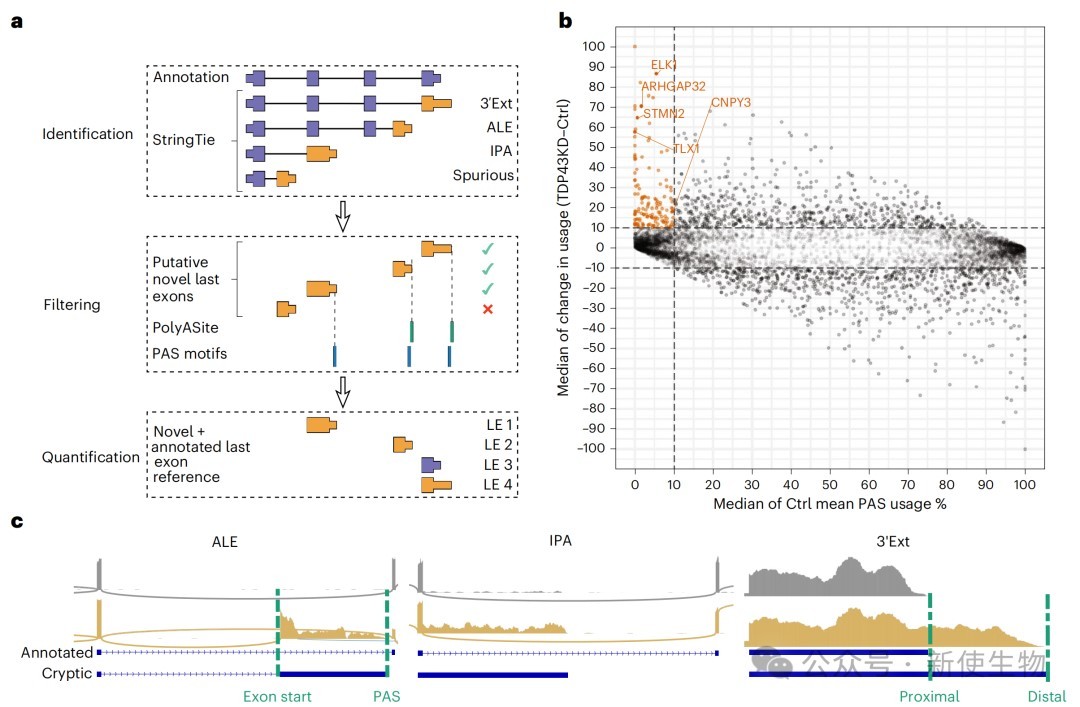
二、TDP-43通过直接结合来双向调控APA位点的选择
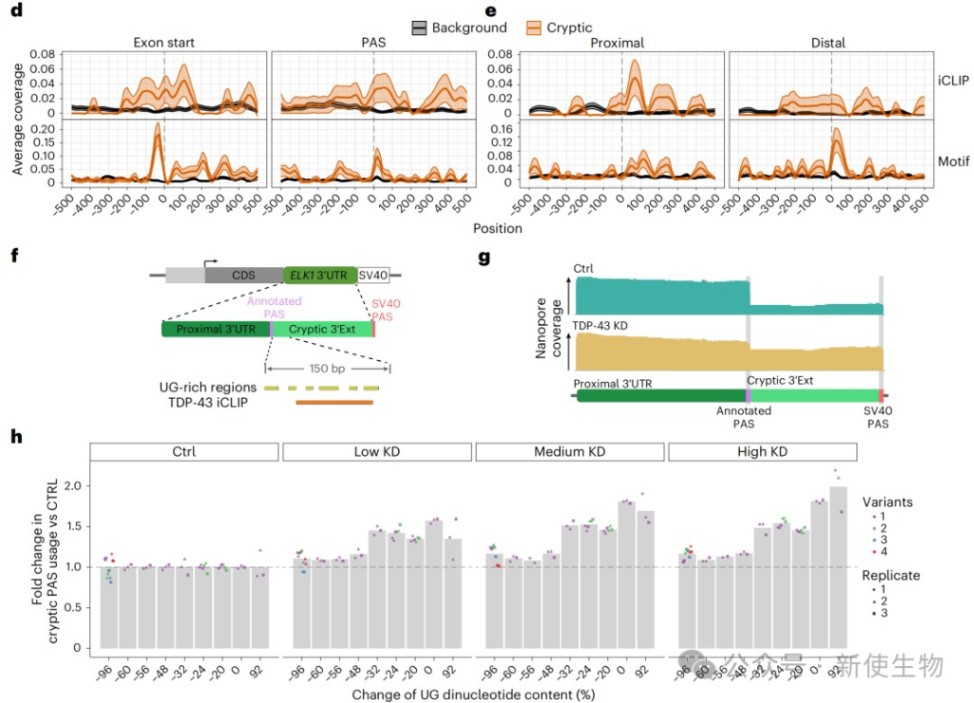
通过分析TDP-43的iCLIP数据,作者发现TDP-43的结合位点在这些隐性APA事件区域显著富集。
TDP-43的结合模式揭示了其双重调控作用:它既可以通过结合在隐性ALE的上游剪接位点附近来抑制其使用,也可以通过结合在3' UTR延伸事件的正常poly(A)位点下游来增强该位点的使用,从而在正常情况下阻止隐性位点的激活。
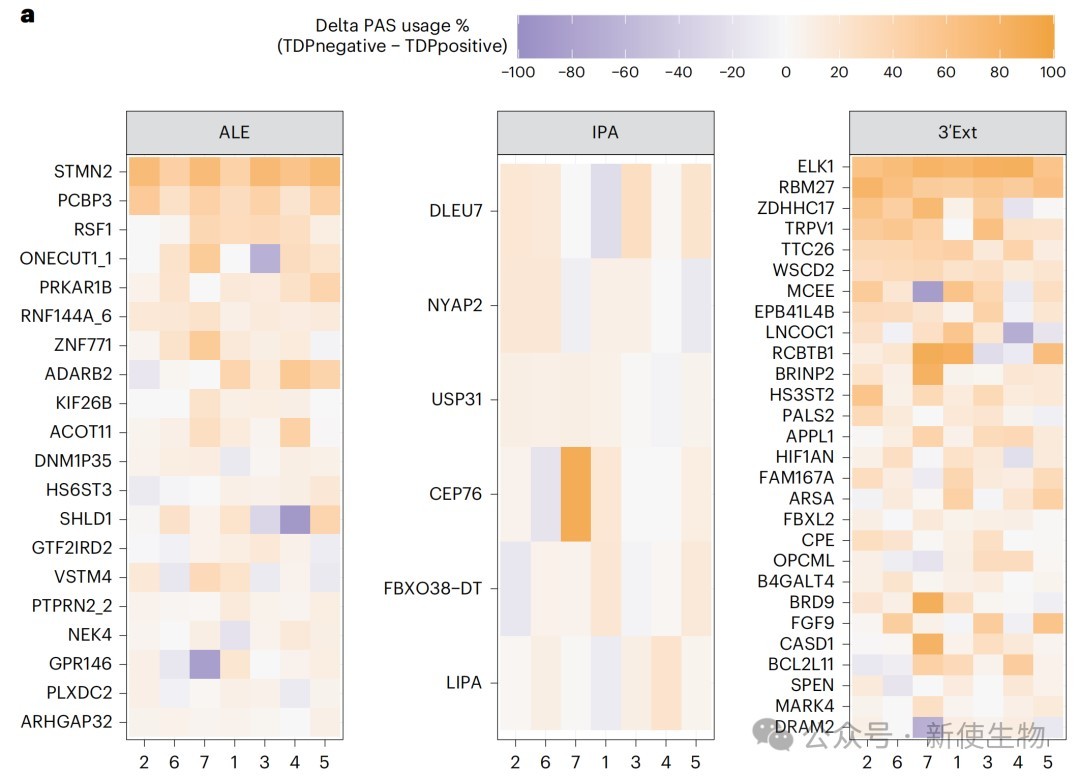
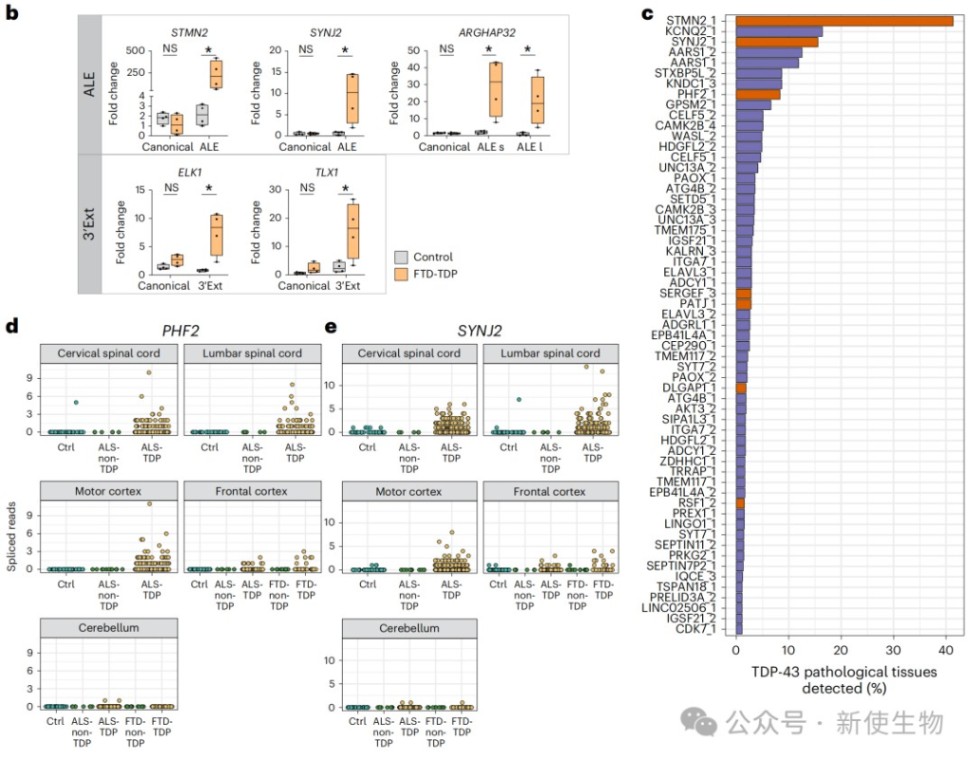
三、隐性APA事件在ALS/FTD患者脑组织中同样存在
作者在ALS和FTD患者的尸检脑组织中检测到了多种类型的隐性APA事件。
特别是在TDP-43核内耗竭的神经元中,隐性ALE和3' Ext事件的丰度显著增加,其增加幅度与已知的关键隐性外显子STMN2相当。
这一发现证实了隐性APA是TDP-43相关病理的真实分子特征。
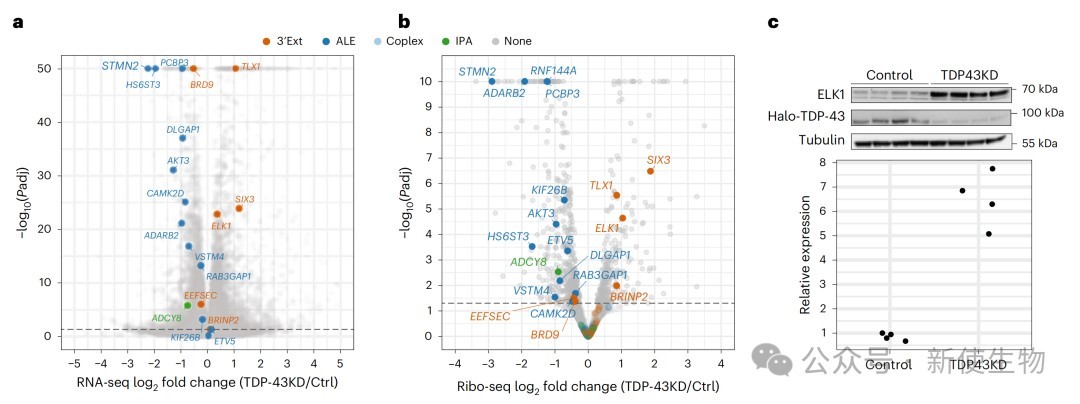
四、隐性APA对转录本和蛋白质水平有不同的下游效应
通过结合RNA-seq、SLAM-seq和Ribo-seq核糖体印迹分析,研究团队发现不同类型的隐性APA事件对基因表达的影响各不相同。
与通常导致转录本降解的隐性外显子不同,作者发现一类名为“隐性3' UTR延伸”的事件,反而会增加RNA的稳定性。
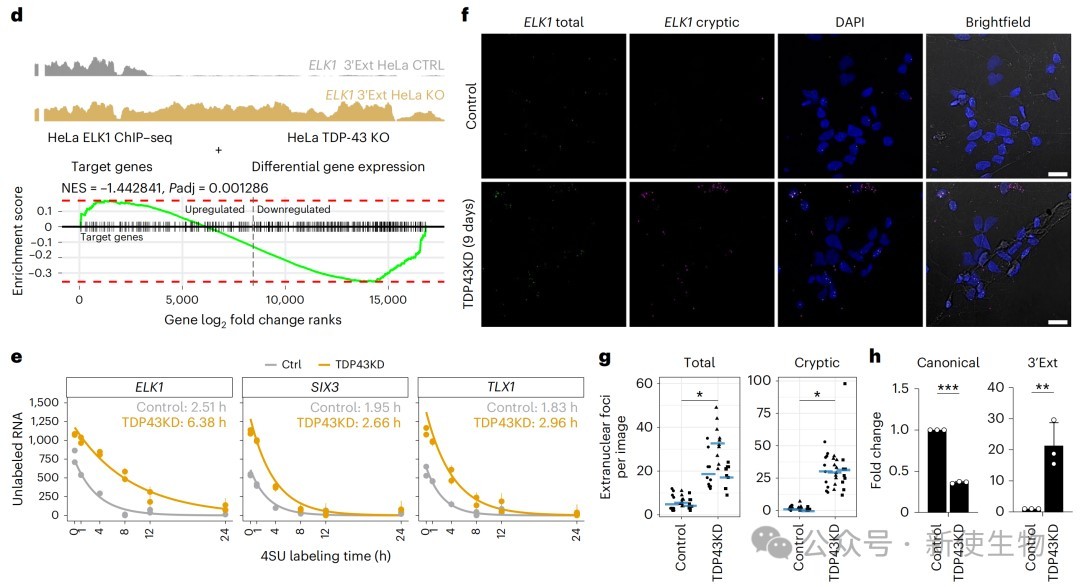
五、隐性3' UTR延伸通过提高RNA稳定性来增强蛋白质翻译和功能
作者发现这些延伸的转录本具有更长的半衰期,能够有效地定位到细胞质中,并与核糖体结合进行翻译。
这最终导致了相应蛋白质水平的显著升高,并影响了其下游靶基因的表达,揭示了一种由TDP-43缺失引起的功能获得性致病机制。
总结
本研究通过开发新的生物信息学工具,系统地揭示了TDP-43核内缺失在ALS/FTD中会诱导一类此前被忽视的RNA加工错误,即隐性可变多聚腺苷酸化(cryptic APA)。研究不仅证实了这些事件在患者脑组织中的存在,更重要的是发现,与传统的导致蛋白功能丧失的隐性剪接不同,特定类型的隐性APA能够通过增强RNA稳定性,反而上调正常蛋白的表达和功能。这一发现拓展了我们对TDP-43功能丧失分子后果的认知,为相关神经退行性疾病的发病机制和生物标志物开发提供了新的方向。
| 新使生物专业翻译组一站式服务平台 |
| 产品名称 |
我们能够针对微量细胞或组织,如卵母细胞、卵巢、临床穿刺样品等产出高质量翻译组数据结果。
超高的准确性为研究非经典的开放阅读框(ORFs)提供极大便利,提高微肽(肿瘤新生抗原)的挖掘效率。
另外新使生物提供多物种多聚核糖体分析(Polysome profiling),了解更多翻译组技术信息可登录 www.neoribo.com。
点击图片查看
点击图片查看


 关于我们
关于我们 产品中心
产品中心 技术服务
技术服务 技术中心
技术中心 联系我们
联系我们